
����Ŀ�������γɶ��ֵ��ʻ���ش��������⣺
(1)����(P4)��������ȼ�ղ���������ɫ����������PCl3��PCl5��
��P4��ѧ���ʱ�N2���õ���Ҫԭ����___________________________��
���γ�PCl5ʱ��Pԭ�ӵ�һ��3s���Ӽ�����3d��������ɼ���д���ü���̬ԭ�ӵ���Χ���ӹ����ʾʽ___________________________________��
��PCl5��һ�ְ�ɫ���壬��ѹ����148��Һ�����γ����ӵ��壬����������Ϊ��������ṹ��������Ϊ��������ṹ�������ӵ����ܵ����ԭ����_______(�õ��뷽��ʽ����)��
(2)���Ͱ뵼����� ���ף���һ�ֶ�ά����(�ṹ����ͼ����ʾ)���䵥��Ľṹ����ͼ����ʾ��
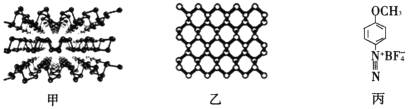
�ٺ�����Pԭ�ӵ��ӻ���ʽΪ_____________________________��
����4���������ص����ķ�������(����ͼ����ʾ)�����������ײ��ϣ����Ա����Ϳ��������ʡ����εĹ���Ԫ����N��O��F�ĵ縺���ɴ�С˳��Ϊ__________________��1mol���ε������Ӻ��е���������ĿΪ____________(�����ӵ�������ֵ��NA��ʾ����ͬ)��
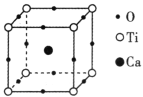
(3)�й���ѧԺ�����Ƚ������о�Ժ�ڸ��ѿ�/���������ϲ��ϵ��о�����ȡ���½�չ���ò��ϱ��ֳ�����Ĺ��Ӧ��DZ������ͼ��ʾΪ���³����������һ�ֻ����� ���ѿ��ṹ����ͼ��������߳�Ϊa nm����þ�����ܶ�Ϊ____________g��cm��3��
���𰸡�P4�����д���P-P��������N2�����д���N��N�������ܽϴ�ѧ���ʱȽ��ȶ� ![]() 2PCl5��
2PCl5��![]() +
+![]() sp3 F��O��N 17NA
sp3 F��O��N 17NA ![]()
��������
����P4��N2�Ľṹ���ӹ��ۼ��ļ��ܴ�С�ó�P4��ѧ���ʱ�N2���õ���Ҫԭ����PCl5�У�Oԭ�ӵļ۵����Ų�ʽΪ3s23p3����Pԭ�ӵ�һ��3s���Ӽ�����3d����۵����Ų�ʽΪ3s13p33d1���ɴ�д���伤��̬ԭ�ӵ���Χ���ӹ����ʾʽ��PCl5��ѹ����148��Һ�����γ����ӵ��壬������������ṹ��������Ϊ![]() ����������ṹ��������Ϊ
����������ṹ��������Ϊ![]() ���ں����У�ÿ��Pԭ������Χ��4��Pԭ���γɹ��ۼ����ɴ˿ɵó�Pԭ�ӵ��ӻ���ʽ���Ƚ�N��O��F�ĵ縺��ʱ�����ȱȽϷǽ����ԣ��ǽ�����Խǿ���縺��Խ���ε��������У��ж��ٸ�ԭ�Ӽ��γɹ��ۼ����ͺ��ж��ٸ�������������ܶ�ʱ�������1�������������е�Ca��Ti��Oԭ�Ӹ������Ӷ����1�������������������1���������������ɵó�������ܶȡ�
���ں����У�ÿ��Pԭ������Χ��4��Pԭ���γɹ��ۼ����ɴ˿ɵó�Pԭ�ӵ��ӻ���ʽ���Ƚ�N��O��F�ĵ縺��ʱ�����ȱȽϷǽ����ԣ��ǽ�����Խǿ���縺��Խ���ε��������У��ж��ٸ�ԭ�Ӽ��γɹ��ۼ����ͺ��ж��ٸ�������������ܶ�ʱ�������1�������������е�Ca��Ti��Oԭ�Ӹ������Ӷ����1�������������������1���������������ɵó�������ܶȡ�
(1)��P4�ĽṹʽΪ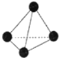 ��N2�ĽṹʽΪN��N����ѧ���ʱ�N2���õ���Ҫԭ����P4�����д���P-P��������N2�����д���N��N�������ܽϴ�ѧ���ʱȽ��ȶ�����Ϊ��P4�����д���P-P��������N2�����д���N��N�������ܽϴ�ѧ���ʱȽ��ȶ���
��N2�ĽṹʽΪN��N����ѧ���ʱ�N2���õ���Ҫԭ����P4�����д���P-P��������N2�����д���N��N�������ܽϴ�ѧ���ʱȽ��ȶ�����Ϊ��P4�����д���P-P��������N2�����д���N��N�������ܽϴ�ѧ���ʱȽ��ȶ���
���γ�PCl5ʱ��Pԭ�ӵ�һ��3s���Ӽ�����3d��������ɼ����۵����Ų�ʽΪ3s13p33d1���ü���̬ԭ�ӵ���Χ���ӹ����ʾʽΪ![]() ����Ϊ��
������![]() ��
��
��PCl5��һ�ְ�ɫ���壬��ѹ����148��Һ�����γ����ӵ��壬������������ṹ��������Ϊ![]() ����������ṹ��������Ϊ
����������ṹ��������Ϊ![]() ��Һ������������ƶ������������ӣ������ӵ����ܵ����ԭ����2PCl5��
��Һ������������ƶ������������ӣ������ӵ����ܵ����ԭ����2PCl5��![]() +
+![]() ������2PCl5��
������2PCl5��![]() +
+![]() ��
��
(2)���ں����У�ÿ��Pԭ������Χ��4��Pԭ���γɹ��ۼ���������Pԭ�ӵ��ӻ���ʽΪsp3����Ϊ��sp3��
�ڸ��εĹ���Ԫ���У�N��O��F�ķǽ�����F��O��N����縺���ɴ�С˳��ΪF��O��N�����ε�������Ϊ![]() ��1����������ԭ�Ӽ乲�γ�17�����۵�����˫����������ÿ2��ԭ�Ӽ�ֻ���γ�1������������1mol���������к��е���������ĿΪ17NA����Ϊ��F��O��N��17NA��
��1����������ԭ�Ӽ乲�γ�17�����۵�����˫����������ÿ2��ԭ�Ӽ�ֻ���γ�1������������1mol���������к��е���������ĿΪ17NA����Ϊ��F��O��N��17NA��
(3)��ͼ�У�1�������й�����Ca�ĸ���Ϊ1����Ti�ĸ���Ϊ8��![]() =1����O�ĸ���Ϊ12��
=1����O�ĸ���Ϊ12��![]() =3��������߳�Ϊa nm����þ�����ܶ�Ϊ
=3��������߳�Ϊa nm����þ�����ܶ�Ϊ![]() =
=![]() g��cm��3������
g��cm��3������![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з���ʽ����ˮ�ⷴӦ����ʽ���ǣ� ��
A.H2CO3![]() HCO3-+H+B.HCO3-+H2O
HCO3-+H+B.HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
C.HCO3-+OH-=H2O+CO32-D.CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������б仯�����ƶϣ�
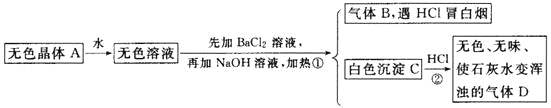
����֪��A��ǿ�Ȳ�������̬���ʵ�ƽ����Է�������Ϊ26��3��
��1���ƶ�A��B��C��D�Ļ�ѧʽ��A________��B________��C________��D________��
��2��д���٢��仯�����ӷ���ʽ��
��________________________________________________________________��
��________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���M�Ľṹ��ʽ���£�������NaOHˮ��Һ�м��ȣ�Ȼ�������������ữ��õ����ֲ�ͬ���л���A��B��C����A��B��C������̼ԭ�����������ӡ��ش��������⣺
��֪��ͬһ��̼ԭ���Ͻ�������ǻ����Զ���ˮ����ȩ����
��1�� 1mol M������������������NaOHˮ��Һ��Ӧ������NaOH�����ʵ���Ϊ___��
��2�� B�к��еĹ���������Ϊ____��
��3�� C���ܷ����ķ�Ӧ������____��������ţ�
�ټӳɷ�Ӧ����ȥ��Ӧ����ɫ��Ӧ��ȡ����Ӧ
��4��A��ŨH2SO4�����¿�������Ԫ��״������仯ѧ����ʽΪ___��
��5��A������ͬ���칹��E��F�ֱ��������ص㣺
��lmol E��F���Ժ�3mol Na������Ӧ���ų���״����33.6L H2��
��lmol E��F���Ժ�����NaHCO3��Һ��Ӧ������lmol CO2��
��lmol E��F���Է���������Ӧ������2mol Ag��
��E��F�Ľṹ��ʽ�ֱ���_____��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ܱ������г���1 mol H2��1 mol Br2����һ���¶���ʹ�䷢����Ӧ��H2(g)��Br2(g)![]() 2HBr(g) ���ﵽ��ѧƽ��״̬��������²������й������������
2HBr(g) ���ﵽ��ѧƽ��״̬��������²������й������������
A. ���������ݻ����䣬�����м���1 mol H2������Ӧ��������ƽ�������ƶ�����H2��ת���ʱ�ԭƽ���
B. ���������ݻ����䣬�����м���1mol He�����ı�����ʵ�Ũ�ȣ���ѧ��Ӧ���ʲ��䣬ƽ�ⲻ�ƶ�
C. ��������������ѹǿ���䣬�����м���1 mol He����Ӧ��Ũ���½�����ѧ��Ӧ���ʼ�����ƽ�������ƶ�
D. ��������������ѹǿ���䣬�����м���1 mol H2��1 mol Br2��ƽ�������ƶ�����H2���յ�ת������ԭƽ��һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪HCO3��+AlO2��+H2O�TCO32��+Al��OH��3������������KHCO3��Һ���ϵ��뺬�����ʵ�����KOH��Ba��OH��2��KAlO2�Ļ����Һ�У����ɳ��������ʵ���������KHCO3��Һ����Ĺ�ϵ�ɱ�ʾΪ�� ��
A. 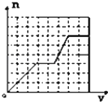 B.
B.  C.
C.  D.
D. 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��Ϊ����������Ԫ�أ�B��C��D�����ڱ��е�λ�ù�ϵ����ͼ��ʾ��A�Ƕ�������ԭ�Ӱ뾶��С��Ԫ�أ�A��B��C����Ԫ�ص�ԭ������֮�͵���DԪ�ص�ԭ��������E�Ƕ�����������õĽ���Ԫ�ء�����˵���������

A. �����ӵİ뾶��С��ϵ��B��C��E
B. CԪ�ص���̬�⻯���DԪ�ص���̬�⻯���ȶ��������Ե��
C. ��A��B����Ԫ����ɵ����ӻ�����NH5�У����������Ӹ�����Ϊ1:1
D. ��C��D��E����Ԫ����ɵ�ij�ֻ������ˮ��Һ�������ᷴӦ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��MnO2�ڵ�ء��������л��ϳɵȹ�ҵ������Ӧ�ù㷺�����ô�MnO2����������MnO��MnCO3����ȡ��MnO2��������ͼ��
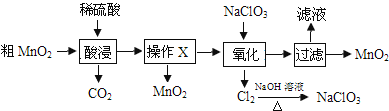
����˵��������ǣ� ��
A.���������ϡ�������ϡ���ᡢϡ�������
B.����X�������ǹ���
C.�������̷�����Ӧ�����ӷ���ʽΪ5Mn2++2ClO![]() +4H2O=5MnO2��+Cl2��+8H+
+4H2O=5MnO2��+Cl2��+8H+
D.���MnSO4��ҺҲ���Ƶ�MnO2�������缫ʽΪMn2+-2e-+2H2O=MnO2��+4H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ����Ҫ������
��1���������������ȷ�Ӧ���Ӹֹ죬������������������Ӧ�Ļ�ѧ����ʽΪ��___
��2������NaOH��Һ��Ӧ�����ӷ���ʽΪ��___��
��3����ҵ������������Ҫ�ɷ�ΪA12O3������������Fe2O3��SiO2�����ʣ���ȡ��������ұ������ԭ�ϣ���ȡ�IJ����������£�
��I��II�����з�����Һ�ͳ����IJ����ǣ�___��
�ڳ���M�г�������ɳ�⣬һ��������___������N��___��
����ҺX�У�����Ԫ�ص����ʵĻ�ѧʽΪ___��������___����ᡱ��������Ρ��������ʣ�
��ʵ�����ﳣ��AlCl3��Һ�м���___�����ˮ����NaOH��Һ��������ȡA1��OH��3���䷴Ӧ�����ӷ���ʽΪ��___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com