
【题目】在一密闭容器中充入1 mol H2和1 mol Br2,在一定温度下使其发生反应:H2(g)+Br2(g)![]() 2HBr(g) ,达到化学平衡状态后进行如下操作,有关叙述错误的是
2HBr(g) ,达到化学平衡状态后进行如下操作,有关叙述错误的是
A. 保持容器容积不变,向其中加入1 mol H2,正反应速率增大,平衡正向移动,但H2的转化率比原平衡低
B. 保持容器容积不变,向其中加入1mol He,不改变各物质的浓度,化学反应速率不变,平衡不移动
C. 保持容器内气体压强不变,向其中加入1 mol He,反应物浓度下降,化学反应速率减慢,平衡逆向移动
D. 保持容器内气体压强不变,向其中加入1 mol H2和1 mol Br2,平衡正向移动,但H2最终的转化率与原平衡一样
科目:高中化学 来源: 题型:
【题目】将图1所示装置中的盐桥(琼脂-饱和![]() 溶液)换成铜导线与石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转。下列说法正确的是
溶液)换成铜导线与石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转。下列说法正确的是
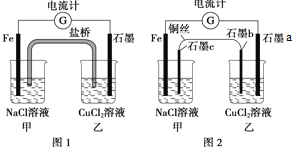
A. 图1中,铁棒质量减少5.6g,则甲池![]() 溶液的质量增加5.6g
溶液的质量增加5.6g
B. 图1中的石墨电极与图2中乙池石墨![]() 电极的电极反应式相同
电极的电极反应式相同
C. 两图所示装置的能量变化均是将化学能转化为电能
D. 图2中电子流向为![]() 电流计→石墨a→石墨b→铜丝→石墨c→
电流计→石墨a→石墨b→铜丝→石墨c→![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高压直流电线路的瓷绝缘子经常出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀,防护原理如图所示。下列说法错误的是( )

A.断电时,牺牲阳极保护法使铁帽不被腐蚀
B.通电时,阳极上的电极反应为Zn-2e-=Zn2+
C.断电时,锌环上的电极反应为Zn-2e-=Zn2+
D.铁帽上加铜环也能防止铁被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲图是部分短周期元素的常见化合价与原子序数的关系图:

请回答下列问题:
(1)甲图中C元素的中子数为7,其原子符号为_____,元素I与G同主族,位于第四周期则元素I的原子结构示意图______。
(2)F、G、H元素气态氢化物的稳定性由强到弱的顺序为_______________(用化学式表示)
(3)化合物X是B元素的最高价氧化物,其电子式为_________,甲图中C元素的一种氢化物Y是10电子微粒, Y与O2发生置换反应的化学方程式为_________。
(4)H的最高价氧化物对应的水化物的浓溶液不稳定,受热可分解,产物之一是H的单质,且当有28mol电子转移时,恢复至室温共产生9mol气体,写出该反应的化学方程式__________。
(5)由上述元素中的几种组成a、b、c、d各物质,某同学设计实验用乙图装置证明元素B、C、F的非金属性强弱(其中溶液b和溶液c均为足量)。
①溶液a和b分别为_____,___(填化学式)。
②溶液c中的离子方程式为_________。
③请从原子结构的角度解释非金属性C>B的原因_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A制备F的一种合成路线如图:

已知:![]()
(1)A的化学名称为___,D中官能团的名称是___。
(2)②、⑤的反应类型分别是___、___。
(3)②的反应条件是___,有机物X的结构简式为___。
(4)反应⑤的化学方程式为___。
(5)芳香化合物H是D的同分异构体,满足下列条件的同分异构体共有___种(不考虑立体异构);其中核磁共振氢谱为四组峰,峰面积比为1:2:2:1的结构简式为___。
a.能发生银镜反应b.含有-C≡CH结构c.无-C≡C-O-结构
(6)设计由1-丁炔和乙炔为原料制备化合物![]() 的合成路线:(无机试剂任选)___。
的合成路线:(无机试剂任选)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是

A. a为负极,是铁片,烧杯中的溶液为硫酸
B. b为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C. a为正极,是碳棒,烧杯中的溶液为硫酸
D. b为正极,是碳棒,烧杯中的溶液为硫酸铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 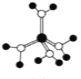 水合铜离子的球棍模型,1个水合铜离子有2个配位键
水合铜离子的球棍模型,1个水合铜离子有2个配位键
B.  冰晶胞示意图,类似金刚石晶胞,冰晶胞内水分子间以共价键结合
冰晶胞示意图,类似金刚石晶胞,冰晶胞内水分子间以共价键结合
C.  H原子的电子云图,由图可见H原子核外靠近核运动的电子多
H原子的电子云图,由图可见H原子核外靠近核运动的电子多
D. 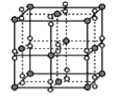 K与氧形成的某化合物晶胞,其中黑球为K+,由图可知该晶体化学式为KO2
K与氧形成的某化合物晶胞,其中黑球为K+,由图可知该晶体化学式为KO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com