
【题目】现有物质的量浓度均为0.1 mol/L的溶液①NH3·H2O ②CH3COOH ③KHSO4。下列有关离子浓度分析一定不正确的是( )
A.向①中逐滴加入少量②,![]() 逐渐增大
逐渐增大
B.①、③等体积混合后溶液中存在:NH4+ +H2O![]() NH3·H2O+H+
NH3·H2O+H+
C.①、②任意比混合:c(CH3COO-)+c(OH-)=c(H+)+c(NH4+ )
D.①、③按体积比2:1混合:c(NH4+)>c(NH3H2O)>c(SO42-)>c(OH-)>c(H+)
【答案】D
【解析】
A选项,向①中逐滴加入少量②,反应消耗一水合氨,生成醋酸铵,c(NH4+)增大,c(NH3H2O)减小,![]() 逐渐增大,故A正确;
逐渐增大,故A正确;
B选项,①、③等体积混合溶质KNH4SO4,溶液中铵根离子水解:NH4+ +H2O![]() NH3·H2O+H+,故B正确;
NH3·H2O+H+,故B正确;
C选项,①、②任意比混合遵循电荷守恒思想,即c(CH3COO-)+c(OH-)=c(H+)+c(NH4+),故C正确;
D选项,①、③按体积比2:1混合,溶液中溶质主要是:NH3·H2O和KNH4SO4 ,溶液主要以电离为主,因此c(NH4+)>c(SO42-)>c(NH3·H2O) >c(OH-)>c(H+),故D错误;
综上所述,答案为D。


科目:高中化学 来源: 题型:
【题目】在下列各溶液中,离子一定能大量共存的是
A.强碱性溶液中:K+、Al3+、Cl-、SO![]()
B.含有0.1mol·L-1Fe3+的溶液中:K+、Mg2+、I-、NO![]()
C.含有0.1mol·L-1Ca2+溶液在中:Na+、K+、CO![]() 、Cl-
、Cl-
D.室温下,pH=1的溶液中:Na+、Fe3+、NO![]() 、SO
、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组比较Cl-、Br-、I-的还原性,实验如下:
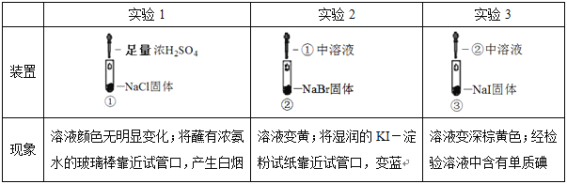
下列对实验的分析不合理的是
A.实验1中,白烟是NH4Cl
B.根据实验1、2,可以判断还原性:Br->Cl-
C.根据实验3,可以判断还原性:I->Br-
D.上述实验体现了浓硫酸的强氧化性、难挥发性等性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有氯化钠和碘化钠的混合物共26.7 g,溶于水,通入足量氯气后,蒸干、灼烧,固体质量变为 17.55 g。
(1)原混合物中碘化钠的质量是________。
(2)原混合物中氯化钠的质量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温下,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A.HA电离出的c(H+)与水电离出的c(H+)之比为108
B.升高温度,溶液的pH减小
C.溶液的pH=4
D.HA的电离平衡常数约为l×10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,用浓度为0.1000 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.1000 mol·L-1的三种酸HX、HY、HZ滴定曲线如图所示。下列说法正确的是
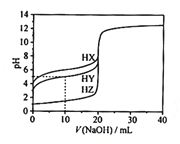
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX
B.根据滴定曲线,可得Ka(HY)≈10-6
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(Na+)>c(H+)
D.HY与HZ混合,达到平衡时:c(H+)=c(Y-)+c(Z-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式_________________________。
(2)若溶液M由10mL 2 mol·L-1NaHA溶液与10mL 2mol·L-1NaOH溶液混合而得,则溶液M的pH ________7 (填“>”、“<”或“=”),溶液中离子浓度由大到小顺序为__________________________。(溶液混合时体积变化忽略,下同)
(3)已知Ksp(BaA)= 1.8×10-10,向⑵的混合溶液中加入10mL 1 mol·L-1 BaCl2溶液,混合后溶液中的Ba2+浓度为___________ mol·L-1。
(4)25℃时,amol/L氨水和0.01mol/L盐酸等体积混合充分反应后,c(NH4+)= c(Cl-)求一水合氨的电离常数K= _____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的镁、铝混合物投到2mol·L-1的盐酸中,待金属完全溶解后,再向溶液中逐滴加入2mol·L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示。
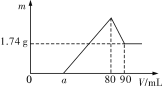
则:
(1)0~amL、a~80mL、80~90mL对应反应的离子方程式分别为:
①0~amL:___;
②amL~80mL:__、__;
③80mL~90ml:___。
(2)金属铝的质量为___。
(3)盐酸的体积是__mL。
(4)![]() =__。
=__。
(5)a=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是氯化铯晶体的晶胞(晶体中的最小重复单元),已知晶体中两个最近的Cs+离子核间距离为a cm,氯化铯的相对分子质量为M,NA为阿伏加德罗常数,则氯化铯晶体密度是( )

A. ![]() g/cm3 B.
g/cm3 B. ![]() g/cm3 C.
g/cm3 C. ![]() g/cm3 D.
g/cm3 D. ![]() g/cm3
g/cm3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com