
【题目】一定质量的镁、铝混合物投到2mol·L-1的盐酸中,待金属完全溶解后,再向溶液中逐滴加入2mol·L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示。
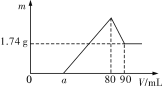
则:
(1)0~amL、a~80mL、80~90mL对应反应的离子方程式分别为:
①0~amL:___;
②amL~80mL:__、__;
③80mL~90ml:___。
(2)金属铝的质量为___。
(3)盐酸的体积是__mL。
(4)![]() =__。
=__。
(5)a=__。
【答案】OH-+H+=H2O Al3++3OH-=Al(OH)3↓ Mg2++2OH-=Mg(OH)2↓ Al(OH)3+OH-=AlO2-+2H2O 0.54g 80 1.5(或3∶2) 20(mL)
【解析】
0~a段没有生成沉淀,说明盐酸过量,加入的氢氧化钠与氯化氢反应;a~80段开始生成沉淀,加入80mL氢氧化钠溶液后沉淀达到最大量,此时溶液中的溶质为NaCl;80~90段氢氧化铝开始溶解,溶解氢氧化铝消耗了10mLNaOH,则氢氧化铝沉淀的物质的量为:2mol/L×0.01L=0.02mol;当加入90mLNaOH溶液后氢氧化铝完全溶解,此时沉淀只有氢氧化镁,
(1)①0~amL为氢氧化钠与氯化氢反应生成氯化钠和水;
②amL~80mL为氢氧化钠分别于氯化铝和氯化镁反应生成氢氧化铝和氢氧化镁沉淀与氯化钠;
③80mL~90ml为氢氧化铝与氢氧化钠反应生成偏铝酸钠和水;
(2)氢氧化钠的体积在80至90mL段内,所有的氢氧化钠用于溶解氢氧化铝,根据氢氧化钠的量确定氢氧化铝的量,根据原子守恒确定金属铝的量;
(3)加入80mL氢氧化钠溶液时,溶质为NaCl,根据质量守恒可以计算出氯化氢的物质的量,再根据V=![]() 计算出盐酸的体积;
计算出盐酸的体积;
(4)由图得到氢氧化镁的质量,根据公式计算出氢氧化镁的物质的量,根据原子守恒确定金属镁的量;
(5)根据金属镁和铝的物质的量算出氯化铝和氯化镁的物质的量,根据化学方程式算出氢氧化钠反应的物质的量,用公式算出体积,则a=80-氢氧化钠的体积,据此解答。
0~a段没有生成沉淀,说明盐酸过量,加入的氢氧化钠与氯化氢反应;a~80段开始生成沉淀,加入80mL氢氧化钠溶液后沉淀达到最大量,此时溶液中的溶质为NaCl;80~90段氢氧化铝开始溶解,溶解氢氧化铝消耗了10mLNaOH,则氢氧化铝沉淀的物质的量为:2mol/L×0.01L=0.02mol;当加入90mLNaOH溶液后氢氧化铝完全溶解,此时沉淀只有氢氧化镁;
(1)①0~amL为氢氧化钠与氯化氢反应生成氯化钠和水,离子方程式为:OH-+H+=H2O;
②amL~80mL为氢氧化钠分别于氯化铝和氯化镁反应生成氢氧化铝和氢氧化镁沉淀与氯化钠,离子方程式为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓;
③80mL~90ml为氢氧化铝与氢氧化钠反应生成偏铝酸钠和水,离子方程式为:Al(OH)3+OH-=AlO2-+2H2O;
故答案为:OH-+H+=H2O;Al3++3OH-=Al(OH)3↓;Mg2++2OH-=Mg(OH)2↓;Al(OH)3+OH-=AlO2-+2H2O;
(2)从横坐标80mL到90mL这段可以得出:n(Al(OH)3)=n(NaOH)=0.01L×2mol/L=0.02mol,则n(Al)=n(Al(OH)3)=0.02mol,原混合物中铝的质量为:27g/mol×0.02mol=0.54g;故答案为:0.54g;
(3)加入80mL氢氧化钠溶液时,溶质为NaCl,则n(HCl)=n(NaOH)=2mol/L×0.08L=0.16mol,盐酸的体积为:![]() =0.08L=80mL;故答案为:80;
=0.08L=80mL;故答案为:80;
(4)由图可知m(Mg(OH)2)=1.74g,则n(Mg)=n(Mg(OH)2)=![]() =0.03mol,
=0.03mol,![]() =
=![]() =1.5;故答案为:1.5(或3∶2);
=1.5;故答案为:1.5(或3∶2);
(5)根据元素守恒,n(MgCl2)= n(Mg) =0.03mol,n(AlCl3)=n(Al)=0.02mol,与氢氧化钠反应生成氢氧化镁和氢氧化铝两种沉淀时消耗的n(NaOH)=2n(MgCl2)+3n(AlCl3)=![]() =0.12mol,则V(NaOH)=
=0.12mol,则V(NaOH)=![]() =0.06L=60mL,则与氯化氢反应的氢氧化钠的体积a=80mL-60mL=20mL,故答案为:20(mL)。
=0.06L=60mL,则与氯化氢反应的氢氧化钠的体积a=80mL-60mL=20mL,故答案为:20(mL)。


科目:高中化学 来源: 题型:
【题目】已知A、B、C为中学化学中常见的单质,在室温下A为固体,B和C为气体,向D溶液中加入KSCN溶液后,溶液显红色。在适宜的条件下可发生如下关系的化学反应。
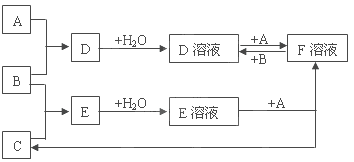
回答以下问题:
(1)A、B、C分别是什么物质:A______B________C________。
(2)写出D溶液中通入SO2的离子方程式:____________________。
(3)若向含amolFeI2和bmolFeBr2的溶液中通入cmol气体B,当I-、Fe2+、Br-被完全氧化时c为:_____(用a、b表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有物质的量浓度均为0.1 mol/L的溶液①NH3·H2O ②CH3COOH ③KHSO4。下列有关离子浓度分析一定不正确的是( )
A.向①中逐滴加入少量②,![]() 逐渐增大
逐渐增大
B.①、③等体积混合后溶液中存在:NH4+ +H2O![]() NH3·H2O+H+
NH3·H2O+H+
C.①、②任意比混合:c(CH3COO-)+c(OH-)=c(H+)+c(NH4+ )
D.①、③按体积比2:1混合:c(NH4+)>c(NH3H2O)>c(SO42-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各组物质中,找出合适的序号填在对应的空格内:
①白磷和红磷;②NO2和N2O4;③12C和14C;④![]() 和
和 ![]() ;⑤C60和金刚石;⑥异戊烷和新戊烷 ;⑦
;⑤C60和金刚石;⑥异戊烷和新戊烷 ;⑦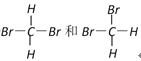
(1)互为同位素的是_____________;
(2)互为同分异构体的是__________;
(3)互为同素异形体的是_________;
(4)同一物质的是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将总物质的量为nmol的钠和铝的混合物(其中钠的物质的量分数为x)投入到一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体VL。下列关系式正确的是( )
A.x=![]()
B.0<x<0.5
C.V=33.6n(1-x)
D.11.2n<V≤22.4n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种Ru络合物与g-C3N4复合光催化剂将CO,还原为HCOOH的原理图如图。
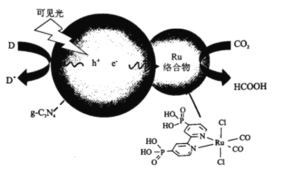
(1)基态碳原子的价电子排布图为___________。
(2)1molHCOOH中含有的σ键数目为___________,HCOOH的沸点比CO2高的原因为___________。
(3)Ru络合物中第二周期元素的第一电离能由大到小的顺序为___________。
(4)Ru络合物中与Ru配位的原子有N、___________。
(5)一类石墨的聚合物半导体g-C3N4,其单层平面结构如图1,晶胞结构如图2。
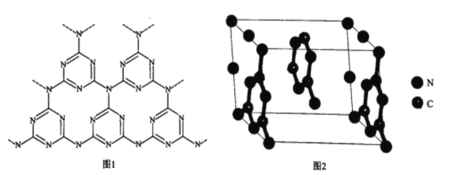
①g-C3N4中氮原子的杂化类型是______________。
②根据图2,在图1中用平行四边形画出一个最小重复单元。______________
③已知该晶胞的体积为Vcm3,中间层原子均在晶胞内部。设阿伏加德罗常数的值为NA,则g-C3N4的密度为______________g.cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有说法不正确的是( )
A.金属的六方最密堆积和面心立方最密堆积的空间利用率最高
B.钠晶胞结构如图,钠晶胞中每个钠原子的配位数为8

C.温度升高,金属的导电性将变小
D.干冰晶体熔化时,1mol干冰要断裂2mol碳氧双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是依据一定的分类标准,对某些物质与水反应情况进行分类的分类图。请根据你所学知识,按要求填空:

(1)上述第一级分类标准(分成A、B组)的依据为:___________。
(2)C组中某一物质常温能与冷水反应,其离子方程式为:_________________。
(3)D组中与水反应时氧化剂和还原剂物质的量之比为1:1的物质,有________(填化学式)。
(4)F组中某一物质的水溶液呈弱碱性,用电离方程式表示呈弱碱性的原因:________。
(5)E组中某一物质的水溶液可使酸性KMnO4溶液褪色,用离子方程式表示褪色的原因:_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或装置能达到目的的是( )
A | B | C | D |
|
|
|
|
除去SO2中的少量HCl | 实验室制取并收集氨气 | 苯萃取碘水中的I2分出水层后的操作 | 实验室制备乙酸乙酯 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com