
【题目】将总物质的量为nmol的钠和铝的混合物(其中钠的物质的量分数为x)投入到一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体VL。下列关系式正确的是( )
A.x=![]()
B.0<x<0.5
C.V=33.6n(1-x)
D.11.2n<V≤22.4n
【答案】D
【解析】
将总物质的量为n mol的钠和铝混合物投入一定量的水中充分反应,钠先与水反应生成氢氧化钠与氢气,铝再与氢氧化钠反应生成偏铝酸钠与氢气。反应的化学方程式为:2Na+2H2O═2NaOH+H2↑,2Al+2NaOH+2H2O═2NaAlO2+3H2↑;金属没有剩余,铝不与水反应,说明反应2Al+2NaOH+2H2O═2NaAlO2+3H2↑中铝与氢氧化钠恰好完全或氢氧化钠过量,以此进行计算。
金属没有剩余,说明反应2Al+2NaOH+2H2O═2NaAlO2+3H2↑中铝与氢氧化钠恰好完全或氢氧化钠过量,否则剩下铝不与水反应;
若恰好反应,即钠与铝按1:1混合,x=0.5,则有钠0.5nmol,铝0.5nmol,由方程式2Na+2H2O═2NaOH+H2↑可知,0.5nmol钠生成氢气0.25nmol;由方程式2Al+2NaOH+2H2O═2NaAlO2+3H2↑可知,0.5nmol铝生成氢气0.75nmol,所以共生成氢气:0.25nmol+0.75nmol=nmol,氢气体积为22.4n L;
若Na过量,即1>x>0.5,则有钠nxmol,铝n(1x)mol,由方程式2Na+2H2O═2NaOH+H2↑可知,nxmol钠生成氢气0.5nxmol;由方程式2Al+2NaOH+2H2O═2NaAlO2+3H2↑可知,n(1x)mol铝生成氢气1.5n(1x)mol,所以共生成氢气:0.5nxmol+1.5n(1x)mol=n(1.5x)mol,氢气体积为:22.4n(1.5x) L;
根据分析可知,Na越多气体总量越少,当即全是钠时,即x=1,生成氢气体积为11.2n L;
所以生成氢气在标况下的体积为11.2n L<VL≤22.4n L,
故答案选D。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸至过量,关于该过程下列说法正确的是
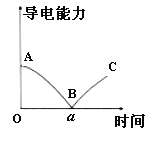
A.Ba(OH)2、稀硫酸均为强电解质
B.C处刻恰好完全中和,反应的离子方程式为:Ba2++OH-+H++SO42-═BaSO4↓+H2O
C.B处溶液的导电能力约为0,说明溶液中此时几乎没有自由移动的离子
D.向NaHSO4溶液中加入过量Ba(OH)2溶液,也能得到与如图完全相同的导电能力变化图像
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温下,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A.HA电离出的c(H+)与水电离出的c(H+)之比为108
B.升高温度,溶液的pH减小
C.溶液的pH=4
D.HA的电离平衡常数约为l×10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式_________________________。
(2)若溶液M由10mL 2 mol·L-1NaHA溶液与10mL 2mol·L-1NaOH溶液混合而得,则溶液M的pH ________7 (填“>”、“<”或“=”),溶液中离子浓度由大到小顺序为__________________________。(溶液混合时体积变化忽略,下同)
(3)已知Ksp(BaA)= 1.8×10-10,向⑵的混合溶液中加入10mL 1 mol·L-1 BaCl2溶液,混合后溶液中的Ba2+浓度为___________ mol·L-1。
(4)25℃时,amol/L氨水和0.01mol/L盐酸等体积混合充分反应后,c(NH4+)= c(Cl-)求一水合氨的电离常数K= _____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把1 mol CH4 和一定量Cl2组成的混合气体通入大试管中,将此试管倒立在盛有饱和食盐水的水槽中,放在光亮处,回答下列问题:

(1)片刻后试管中的现象为:
①试管内气体的颜色变浅,②试管壁上出现_________________________、③试管内__________________、____________________。
(2)在反应结束后,试管内的产物最多的是___________,空间构型呈正四面体的产物为___________。
(3)若(2)中生成的四种有机产物的物质的量相同,则反应消耗的Cl2的物质的量为________mol。
(4)与CH4相邻同系物的结构简式为_______________该同系物与Cl2发生一氯取代反应的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的镁、铝混合物投到2mol·L-1的盐酸中,待金属完全溶解后,再向溶液中逐滴加入2mol·L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示。
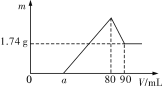
则:
(1)0~amL、a~80mL、80~90mL对应反应的离子方程式分别为:
①0~amL:___;
②amL~80mL:__、__;
③80mL~90ml:___。
(2)金属铝的质量为___。
(3)盐酸的体积是__mL。
(4)![]() =__。
=__。
(5)a=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知反应2HI(g)=H2(g)+I2(g)的△H=+11kJ·mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为______________kJ。
(2)已知某密闭容器中存在下列平衡:CO(g)+H2O(g)![]() CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。
CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。
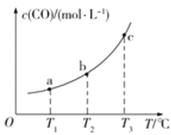
①该反应△H_____________0(填“>”或“<”)
②若T1、T2时的平衡常数分别为K1、K2,则K1_____________K2(填“>”、“<”或“=”)。
(3)在恒容密闭容器中,加入足量的MoS2和O2,仅发生反应:2MoS2(s)+7O2(g)![]() 2MoO3(s)+4SO2(g)ΔH。测得氧气的平衡转化率与起始压强、温度的关系如图所示:
2MoO3(s)+4SO2(g)ΔH。测得氧气的平衡转化率与起始压强、温度的关系如图所示:
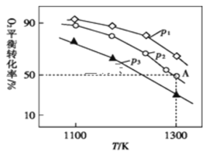
①p1、p2、p3的大小:___________。
②若初始时通入7.0molO2,p2为7.0kPa,则A点平衡常数Kp=___________(用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,写出计算式即可)。
(4)中科院兰州化学物理研究所用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。
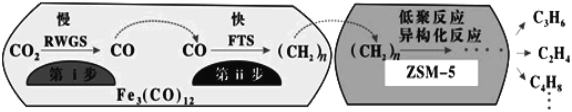
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如表。
助剂 | CO2转化率(%) | 各产物在所有产物中的占比(%) | ||
C2H4 | C3H6 | 其他 | ||
Na | 42.5 | 35.9 | 39.6 | 24.5 |
K | 27.2 | 75.6 | 22.8 | 1.6 |
Cu | 9.8 | 80.7 | 12.5 | 6.8 |
①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加_______助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是:___________
②下列说法正确的是______;
a.第ⅰ步的反应为:CO2+H2![]() CO+H2O
CO+H2O
b.第ⅰ步反应的活化能低于第ⅱ步
c.催化剂助剂主要在低聚反应、异构化反应环节起作用
d.Fe3(CO)12/ZSM-5使CO2加氢合成低碳烯烃的ΔH减小
e.添加不同助剂后,反应的平衡常数各不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO甲烷化反应为:CO(g)+3H2(g)=CH4(g)+H2O(l)。如图是使用某种催化剂时转化过程中的能量变化(部分物质省略),其中步骤②反应速率最慢。
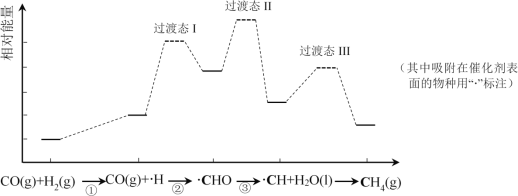
下列说法不正确的是( )
A.步骤①只有非极性键断裂
B.步骤②速率最慢的原因可能是其活化能最高
C.步骤③需要吸收热量
D.使用该催化剂不能有效提高CO的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学方程式的说法正确的是
A. H2的燃烧热为285.8 kJ·mol1,则表示H2燃烧的热化学方程式可表示为:H2(g)+ ![]() O2
O2![]() H2O(g) ΔH=285.8 kJ·mol1
H2O(g) ΔH=285.8 kJ·mol1
B. 中和热为57.3 kJ·mol1,则NaOH与醋酸反应的中和热可以表示如下:NaOH(aq)+CH3COOH(aq)![]() CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
C. 已知:C(s,金刚石)+O2(g)![]() CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)
CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)![]() CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)
CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)![]() C(s,石墨)ΔH=1.9 kJ·mol1
C(s,石墨)ΔH=1.9 kJ·mol1
D. 已知1 mol CH4完全燃烧生成CO2和液态水放出890.4 kJ的热量,则该反应中转移1 mol电子时放出的热量为222.6 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com