
【题目】向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸至过量,关于该过程下列说法正确的是
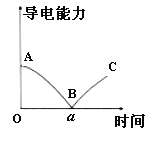
A.Ba(OH)2、稀硫酸均为强电解质
B.C处刻恰好完全中和,反应的离子方程式为:Ba2++OH-+H++SO42-═BaSO4↓+H2O
C.B处溶液的导电能力约为0,说明溶液中此时几乎没有自由移动的离子
D.向NaHSO4溶液中加入过量Ba(OH)2溶液,也能得到与如图完全相同的导电能力变化图像
【答案】C
【解析】
A、Ba(OH)2是强碱,属于强电解质,而稀硫酸是混合物,不属于电解质,故A错误;
B、在滴加过程中,只有一个离子反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,溶液中可自由移动离子逐渐减小,反应恰好完全反应时,溶液导电能力几乎为0,即B处恰好完全中和,故B错误;
C、溶液导电能力与溶液中可自由移动的电荷浓度有关,B点溶液导电能力约为0,由此可知溶液中几乎没有自由移动的离子,故C正确;
D、向NaHSO4溶液中加入过量Ba(OH)2溶液,反应方程式为:Ba(OH)2+ NaHSO4═BaSO4↓+NaOH+H2O,溶液导电能力先下降后上升,但溶液的导电能力不会为0,因为沉淀刚好完全时,溶液中有Na+和OH-,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】下图是一种钯(Pd)的氯配合物X的晶胞结构。回答下列问题:
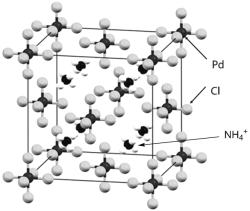
请回答下列问题:
(1)基态Cl原子中存在未成对电子的能级,画出其该能级的轨道表示式______。
(2)下列关于Cl元素的叙述正确的是______ (填序号)。
A.Cl2分子中无π键 B.Cl是p区主族元素
C.第一电离能:Cl<S D.电负性:Cl>S
(3)NCl3分子的中心原子N的杂化方式是______。
(4) NH3常作制冷剂,其键角______ (填“大于”或“小于”)NH4+的键角,NH3的沸点高于N2沸点的主要原因是______。
(5) 物质X的晶体类型为______,其中的Pd元素的化合价为______、配位数为______。
(6) 配合物Y是含有Pd的平面四方的配合物,经过元素分析与计算可知Y中Pd : Cl : N : H的数量比=1:2:2:6。试画出配合物Y的可能结构______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列8种化学符号:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。
。
(1)表示核素的符号共______种。
(2)互为同位素的是________________。
(3)质量相同的H216O和D216O所含中子数之比为________。
根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。试回答下列问题:
(4)写出Be与NaOH溶液反应生成Na2[Be(OH)4]的离子方程式:__________________。
(5)Be(OH)2与Mg(OH)2可用____________________试剂鉴别。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组设计如图实验装置,验证“二氧化碳与水接触时才能和过氧化钠反应”.
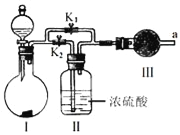
(1)过氧化钠与水反应的化学方程式是__.
(2)装置I是制备纯净的__(填化学式).则装置I中最适宜的试剂组合是__(填字母).
a.稀盐酸 b.稀硫酸 c.小苏打 d.石灰石
(3)实验时,应先打开弹簧夹K2,关闭K1,观察到预期现象后,打开K1,再关闭K2.
(4)实验过程中将带火星的木条置于a口,观察到带火星的木条始终不复燃.
①为观察到最终木条复燃,甲建议在Ⅲ后安装一个盛有碱石灰的干燥管,目的是__;
②乙认为即使采纳甲的建议且最终观察到木条复燃,也不能证明CO2参与了反应,原因是__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠常用作漂白剂、杀菌剂、消毒剂,能与水和二氧化碳等物质发生反应,保存不当时容易变质。某实验小组以过氧化钠为研究对象进行了如下实验。
(1)探究一包Na2O2样品是否已经变质:取少量样品,将其溶解,加入__________溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该实验小组为了粗略测定过氧化钠的质量分数,称取了m g样品,并设计用下图装置来测定过氧化钠的质量分数。
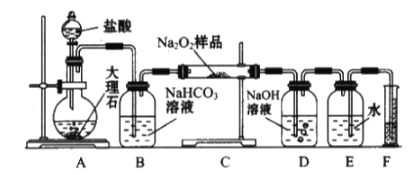
①装置中用于滴加盐酸的仪器的名称是_________,装置D的作用是_________________________________;
②将仪器连接好以后,必须进行的第一步操作是_________________________________;
③写出装置C中发生主要反应的化学方程式_________________________________;
④反应结束后,在读取实验中生成气体的体积时,你认为合理的是_______________(填序号);
a.读取气体体积前,需冷却到室温
b.调整量筒使E、F内液面高度相同
e.视线与凹液面的最低点相平时读取量筒中水的体积
⑤读出量筒内水的体积后,将其折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C为中学化学中常见的单质,在室温下A为固体,B和C为气体,向D溶液中加入KSCN溶液后,溶液显红色。在适宜的条件下可发生如下关系的化学反应。
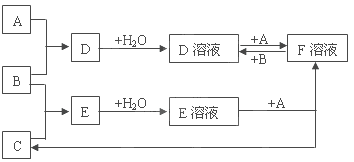
回答以下问题:
(1)A、B、C分别是什么物质:A______B________C________。
(2)写出D溶液中通入SO2的离子方程式:____________________。
(3)若向含amolFeI2和bmolFeBr2的溶液中通入cmol气体B,当I-、Fe2+、Br-被完全氧化时c为:_____(用a、b表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质均为常见物质或它们的溶液,其中 A为淡黄色固体, C、X 均为无色气体,Z为浅绿色溶液,D为一种常见的强碱,F物质不溶于水。根据它们之间的转化关系(下图),回答下列问题:
(部分反应物与产物已省略)
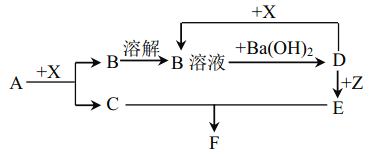
(1)写出下列物质的化学式:X____________ F______________
(2)向Z 溶液中通入足量的Cl2,写出检验所得溶液中阳离子所需试剂_______________________。
(3)向含 10g D 的溶液中通入一定量的 X,完全反应后,在低温条件下蒸发结晶,最终得到 14.8g 固体。
①简述蒸发结晶在低温条件下进行的理由:____________________________________________________(用必要的文字回答)
②所得固体中含有的物质及其它们的物质的量之比为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请综合运用所学知识,填写下列空白:
(1)①中和热测定实验中,除了烧杯、温度计、泡沫塑料、泡沫塑料板外,还需要使用的仪器有_____。
②下列关于中和热的说法正确的是______
A.用稀硫酸和Ba(OH)2溶液代替盐酸与NaOH溶液进行中和热测定,如果准确操作,所测中和热数值可以相同
B.测定中和热时,为保证酸碱充分反应,应将碱溶液缓慢分次倒入酸溶液中,并充分搅拌
C.测定中和热时,温度计测量盐酸溶液的温度后,用蒸馏水洗净再测NaOH溶液温度,实验准确度更高
D.为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量应相等
(2)①某反应历程,假设体系的始态为S,终态为L,它们之间的变化用两段弧线(可以包含任意数目的中间步骤)连接如图所示,则△H1+△H2=______。
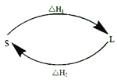
②已知C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H=_______。
(3)①用如图所示装置,在一定条件下讨论锌与稀硫酸的反应速率时,采用一些方法测定了下列物理量,其中可以用于表示(或计算)其化学反应速率的是______
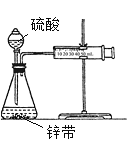
A.收集10mL H2所用的时间 B.一定时间内收集H2的体积
C.一定时间内溶液中H+的浓度变化 D.一定时间内锌粒质量的变化
E.一定时间内反应热量的变化
②为加快一定量的Zn与足量稀硫酸反应的速率,且不影响生成H2的总量,下列措施可行的是_____
A.加入少量CuSO4溶液 B.对反应液适当加热
C.将稀硫酸换成浓硫酸 D.将锌粒换成锌粉
(4)反应a M(g)+a N(g)![]() b W(g)+c Z(g),在体积相同且恒定的两个容器中,按照下列方式加入原料,一段时间后达到平衡:
b W(g)+c Z(g),在体积相同且恒定的两个容器中,按照下列方式加入原料,一段时间后达到平衡:
开始时 | 平衡时 | |||
容器1 | 2mol M | 1mol N | 总压P1 | 0.5mol W |
容器2 | 1mol M | 2mol N | 总压P2 | x mol W |
则x=____,P1_____P2(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将总物质的量为nmol的钠和铝的混合物(其中钠的物质的量分数为x)投入到一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体VL。下列关系式正确的是( )
A.x=![]()
B.0<x<0.5
C.V=33.6n(1-x)
D.11.2n<V≤22.4n
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com