
����Ŀ�����ۺ�������ѧ֪ʶ����д���пհף�
��1�����к��Ȳⶨʵ���У������ձ����¶ȼơ���ĭ���ϡ���ĭ���ϰ��⣬����Ҫʹ�õ�������_____��
�����й����к��ȵ�˵����ȷ����______
A.��ϡ�����Ba(OH)2��Һ����������NaOH��Һ�����к��Ȳⶨ�����ȷ�����������к�����ֵ������ͬ
B.�ⶨ�к���ʱ��Ϊ��֤����ַ�Ӧ��Ӧ������Һ�����ִε�������Һ�У�����ֽ���
C.�ⶨ�к���ʱ���¶ȼƲ���������Һ���¶Ⱥ�������ˮϴ���ٲ�NaOH��Һ�¶ȣ�ʵ��ȷ�ȸ���
D.Ϊȷ�ⶨ������NaOH��Һ��Ӧ���к��ȣ�������ͼ�����ʵ���Ӧ���
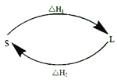
��2����ij��Ӧ���̣�������ϵ��ʼ̬ΪS����̬ΪL������֮��ı仯�����λ��ߣ�������������Ŀ���м䲽�裩������ͼ��ʾ�����H1+��H2=______��
����֪C(s)��H2(g)��CH3COOH(l)��ȼ���ȷֱ�Ϊ393.5kJ/mol��285.8kJ/mol��870.3kJ/mol����Ӧ2C(s)+2H2(g)+O2(g)=CH3COOH(l) ��H=_______��
��3��������ͼ��ʾװ�ã���һ������������п��ϡ����ķ�Ӧ����ʱ������һЩ�����ⶨ�����������������п������ڱ�ʾ������㣩�仯ѧ��Ӧ���ʵ���______
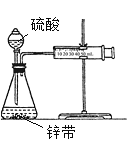
A.�ռ�10mL H2���õ�ʱ�� B.һ��ʱ�����ռ�H2�����
C.һ��ʱ������Һ��H+��Ũ�ȱ仯 D.һ��ʱ����п�������ı仯
E.һ��ʱ���ڷ�Ӧ�����ı仯
��Ϊ�ӿ�һ������Zn������ϡ���ᷴӦ�����ʣ��Ҳ�Ӱ������H2�����������д�ʩ���е���_____
A.��������CuSO4��Һ B.�Է�ӦҺ�ʵ�����
C.��ϡ���ỻ��Ũ���� D.��п������п��
��4����Ӧa M(g)+a N(g)![]() b W(g)+c Z(g)���������ͬ�Һ㶨�����������У��������з�ʽ����ԭ�ϣ�һ��ʱ���ﵽƽ�⣺
b W(g)+c Z(g)���������ͬ�Һ㶨�����������У��������з�ʽ����ԭ�ϣ�һ��ʱ���ﵽƽ�⣺
��ʼʱ | ƽ��ʱ | |||
����1 | 2mol M | 1mol N | ��ѹP1 | 0.5mol W |
����2 | 1mol M | 2mol N | ��ѹP2 | x mol W |
��x=____��P1_____P2������������������������������
���𰸡���Ͳ�����β�������� C 0 -488.3kJ/mol ABCDE BD 0.5 =
��������
��1�������к��Ȳⶨʵ������������֪������Ҫ��Ͳ�Լ����β����������
��A��ϡ����� Ba(OH)2��Һ��Ӧ�������к��������Ե�BaSO4���������ų���������������� NaOH��Һ��Ӧ�࣬������к������ݲ�һ������A����
B������к͵����ʷdz��죬���������룬�ᵼ����������ɢʧ������кͷų�����������ȫ�������ڼ�����Һ��������������ݲ�ȷ����B����
C������������ˮϴ���¶ȼƣ����¶ȼƷ���NaOH ��Һʱ���¶ȼ��ϵ��������NaOH ��Ӧ��������������������Һ�¶Ȳ�ȷ����Cȷ��
D��Ϊ�˱�֤����ȫ�кͣ�һ����Ҫ���Թ�������D����
��2����ʼ̬S����һϵ�з�Ӧ�ٻص�ʼ̬S�����ʱ�������δ�����ı䣬���ݸ�˹���ɿ�֪������ЧӦ��H1+��H2=0��
����C(s)��O2(g)=CO2(g) ��H1=��393.5kJ/mol I
H2(g)��1/2O2(g)=H2O(l) ��H2=-285.8kJ/mol II
CH3COOH(l)��2O2(g)=2CO2(g)��2H2O(l) ��H3=-870.3kJ/mol III
���ݸ�˹���ɿ�֪��2C(s)+2H2(g)+O2(g)=CH3COOH(l) ��H=��H1��2+��H2��2-��H3=-488.3 kJ/mol��
��3���ٵ�λʱ��������������ı仯�����ɱ�ʾ��ѧ��Ӧ���ʿ�����ABCDE����Ӧ�����������DZ������ɴ˿�֪��ABCDE�������������������ڱ�ʾ������㣩�仯ѧ��Ӧ���ʣ��ʴ�Ϊ��ABCDE��
��A���������� CuSO4��Һ����������Cu2��>H������Һ��Zn��Cu2����Ӧ������������Zn������H2�������٣����������⣻
B�����ȿɼӿ컯ѧ��Ӧ���ʣ���Һ���������������ı䣬������H2�������䣬�������⣻
C��Ũ������Zn��Ӧ��������H2�����������⣻
D����п������п�ۣ�����Ӵ��������ѧ��Ӧ���ʼӿ죬����H2�������䣬�������⣻�ʴ�ΪBD��
��4����Ӧ��M��N��ϵ����ͬ���ɱ������ݷ�����֪������1������2��ȫ��Ч����x=0.5��P1=P2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ͼ���Ӧ���ϵ���(����)

A. ���ڴﵽƽ��״̬��N2(g)��3H2(g)![]() 2NH3(g)��t0ʱ�̳�����һ����NH3��ƽ�������ƶ�
2NH3(g)��t0ʱ�̳�����һ����NH3��ƽ�������ƶ�
B. P2>P1��T1>T2
C. ��ͼ���ʾ�ķ���ʽΪ��2A===B��3C
D. ���ڷ�Ӧ2X(g)��3Y(g)![]() 2Z(g)����H<0��y���Ա�ʾY�İٷֺ���
2Z(g)����H<0��y���Ա�ʾY�İٷֺ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������Ba(OH)2��Һ����μ���ϡ���������������ڸù�������˵����ȷ����
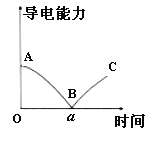
A.Ba(OH)2��ϡ�����Ϊǿ�����
B.C����ǡ����ȫ�кͣ���Ӧ�����ӷ���ʽΪ��Ba2++OH-+H++SO42-�TBaSO4��+H2O
C.B����Һ�ĵ�������ԼΪ0��˵����Һ�д�ʱ����û�������ƶ�������
D.��NaHSO4��Һ�м������Ba(OH)2��Һ��Ҳ�ܵõ�����ͼ��ȫ��ͬ�ĵ��������仯ͼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��Ƚ�Cl-��Br-��I-�Ļ�ԭ�ԣ�ʵ�����£�
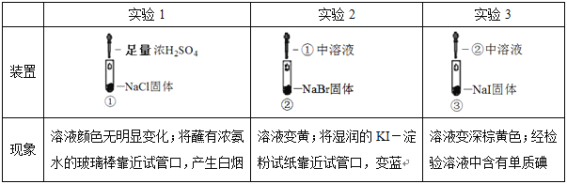
���ж�ʵ��ķ�������������
A.ʵ��1�У�������NH4Cl
B.����ʵ��1��2�������жϻ�ԭ�ԣ�Br-��Cl-
C.����ʵ��3�������жϻ�ԭ�ԣ�I-��Br-
D.����ʵ��������Ũ�����ǿ�����ԡ��ѻӷ��Ե�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�����Ƴ���һ��Ư��Ч�ʼ��ߵ�����Ư�����ṹ��ͼ��ʾ��������W��X��Y��Z��Ϊ������Ԫ����ԭ�����������������£�0.1mol/LZ���⻯���ˮ��ҺpH=1����Z��Yλ�ڲ�ͬ���ڡ�����������ȷ���ǣ� ��
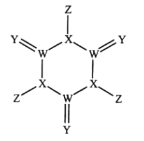
A.ԭ�Ӱ뾶��Z��Y��X��W
B.�⻯��ķе㣺Y��X��Z��W
C.X���������ˮ������ǿ��
D.Y��ij�ֵ��ʾ���ɱ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ��ƺ͵⻯�ƵĻ���ﹲ26.7 g������ˮ��ͨ���������������ɡ����գ�����������Ϊ 17.55 g��
(1)ԭ������е⻯�Ƶ�������________��
(2)ԭ��������Ȼ��Ƶ�����������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����£�0.1 mol��L-1ijһԪ��HA��ˮ����0.1���������룬����������������� ��
A��HA�������c(H+)��ˮ�������c(H+)֮��Ϊ108
B�������¶ȣ���Һ��pH��С
C����Һ��pH=4
D��HA�ĵ���ƽ�ⳣ��ԼΪl��10-7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�ijˮ��ҺM�д��ڵ������У�Na+��A2-��HA-��H+��OH-�����ڵķ�����H2O��H2A����������ش��������⣺
��1��д����H2A�ĵ��뷽��ʽ_________________________��
��2������ҺM��10mL 2 mol��L-1NaHA��Һ��10mL 2mol��L-1NaOH��Һ��϶��ã�����ҺM��pH ________7 ������>������<������=��������Һ������Ũ���ɴ�С˳��Ϊ__________________________������Һ���ʱ����仯���ԣ���ͬ��
��3����֪Ksp(BaA)= 1.8��10-10����ƵĻ����Һ�м���10mL 1 mol��L-1 BaCl2��Һ����Ϻ���Һ�е�Ba2+Ũ��Ϊ___________ mol��L��1��
��4��25��ʱ��amol/L��ˮ��0.01mol/L����������ϳ�ַ�Ӧ��c(NH4+)= c(Cl-)��һˮ�ϰ��ĵ��볣��K= _____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO���黯��ӦΪ��CO(g)+3H2(g)=CH4(g)+H2O(l)����ͼ��ʹ��ij�ִ���ʱת�������е������仯����������ʡ�ԣ������в���ڷ�Ӧ����������
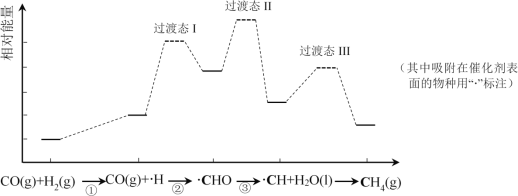
����˵������ȷ���ǣ� ��
A.�����ֻ�зǼ��Լ�����
B.���������������ԭ��������������
C.�������Ҫ��������
D.ʹ�øô���������Ч���CO��ƽ��ת����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com