
【题目】下列实验操作或装置能达到目的的是( )
A | B | C | D |
|
|
|
|
除去SO2中的少量HCl | 实验室制取并收集氨气 | 苯萃取碘水中的I2分出水层后的操作 | 实验室制备乙酸乙酯 |
A.AB.BC.CD.D
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】一定质量的镁、铝混合物投到2mol·L-1的盐酸中,待金属完全溶解后,再向溶液中逐滴加入2mol·L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示。
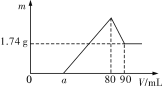
则:
(1)0~amL、a~80mL、80~90mL对应反应的离子方程式分别为:
①0~amL:___;
②amL~80mL:__、__;
③80mL~90ml:___。
(2)金属铝的质量为___。
(3)盐酸的体积是__mL。
(4)![]() =__。
=__。
(5)a=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是氯化铯晶体的晶胞(晶体中的最小重复单元),已知晶体中两个最近的Cs+离子核间距离为a cm,氯化铯的相对分子质量为M,NA为阿伏加德罗常数,则氯化铯晶体密度是( )

A. ![]() g/cm3 B.
g/cm3 B. ![]() g/cm3 C.
g/cm3 C. ![]() g/cm3 D.
g/cm3 D. ![]() g/cm3
g/cm3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A、B、F是家庭中常见的有机物,F常用于食品包装,E是石油化工发展水平的标志。根据下面转化关系回答问题。

(1)分别写出A和E中官能团的名称:A中_________;E中_________;
(2)操作⑥的名称为________________。
(3)写出反应类型:④_________;
(4)请写出下列反应的化学方程式:
①写出A和B在浓硫酸中加热反应的方程式_________________;
②B在金属铜存在下在空气中加热反应________________;
(5)F是一种常见的高分子材料,它给我们带来了巨大的方便。然而,这种材料造成的当今的某一环境问题是__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学方程式的说法正确的是
A. H2的燃烧热为285.8 kJ·mol1,则表示H2燃烧的热化学方程式可表示为:H2(g)+ ![]() O2
O2![]() H2O(g) ΔH=285.8 kJ·mol1
H2O(g) ΔH=285.8 kJ·mol1
B. 中和热为57.3 kJ·mol1,则NaOH与醋酸反应的中和热可以表示如下:NaOH(aq)+CH3COOH(aq)![]() CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
C. 已知:C(s,金刚石)+O2(g)![]() CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)
CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)![]() CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)
CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)![]() C(s,石墨)ΔH=1.9 kJ·mol1
C(s,石墨)ΔH=1.9 kJ·mol1
D. 已知1 mol CH4完全燃烧生成CO2和液态水放出890.4 kJ的热量,则该反应中转移1 mol电子时放出的热量为222.6 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表示溶液中浓度的方法通常有两种:溶液中溶质的质量分数(w)和物质的量浓度(c),因此在配制溶液时,根据不同的需要,有不同的配制方法,请完成填空。
(1)用10%(密度为1.01 g·cm-3)的氢氧化钠溶液配制成27.5 g 2% 的氢氧化钠溶液。
①计算:需________g 10%(密度为1.01 g·cm3)的氢氧化钠溶液,其体积为________mL,需加________mL水(ρ水=1 g·cm-3)进行稀释。
②量取:用________mL量筒取10% 氢氧化钠,量取时视线要跟量筒________保持水平,然后倒入烧杯里,用________mL量筒量取蒸馏水也注入烧杯里。
③溶解:用________将上述溶液搅拌均匀,即得27.5 g 2% 的氢氧化钠溶液。
(2)用98%(密度为1.84 g·cm-3)的浓硫酸稀释成3 mol·L-1的稀硫酸100 mL,回答下列问题:
①需要取浓硫酸________mL;
②配制操作可分解成如下几步,以下正确的操作顺序是__________________________(填字母,下同)。
A.向容量瓶中注入少量蒸馏水,检查是否漏水
B.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C.用已冷却的稀硫酸注入已检查不漏水的容量瓶中
D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使溶液凹面恰好与刻度线相切
H.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线
(3)实验室需配制1 mol·L-1的氢氧化钠溶液和1 mol·L-1的硫酸溶液各100mL。
①要配制氢氧化钠溶液,在用托盘天平称取氢氧化钠固体时,天平读数为________。
A.4.0 g B.4.00 g C.>4.0 g
②在配制氢氧化钠溶液和硫酸溶液的各步操作中,有明显不同的是__________。
A.称量或量取 B.溶解或稀释 C.移液、洗涤 D.定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设计了如图所示实验装置,目的是做钠与水反应实验,并验证①钠的物理性质;②钠与水反应的产物是什么。

(1)当进行适当操作时还需要的仪器有________。
(2)如何进行操作?__________。
(3)实验现象是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1) 化学上采用NH3处理NxOy不仅可以消除污染,还可作为工业生产的能量来源。
已知:2NO(g)=N2(g)+O2(g) △H=-177kJ/mol
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) △H=-1253.4kJ/mol
则用NH3处理NO生成氮气和气态水的热化学方程式为___________________。
(2)已知:N2(g)+3H2(g) ![]() 2NH3(g) △H<0。不同温度下,向三个容器中分别投入相同量的反应物进行反应,测得不同压强下平衡混合物中NH3的物质的量分数如图所示。
2NH3(g) △H<0。不同温度下,向三个容器中分别投入相同量的反应物进行反应,测得不同压强下平衡混合物中NH3的物质的量分数如图所示。

①M点的v正_________Q点的v正(填“>”“<”或“=”)。
②T3温度下,将1molN2和3molH2充入2L的密闭容器中,维持压强为60MPa不变,达到N点的平衡状态,反应的浓度平衡常数K=_____________ (用最简分数表示),M点的平衡常数比N点的平衡常数_________(填“大”“小”或“相等”)。
(3)水体中过量氨氮(以NH3表示)会导致水体富营养化。
①用次氯酸钠除去氨氮的原理如图所示。写出总反应化学方程式:_____________。


②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应一段时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随m(NaClO)∶m(NH3)的变化情况如上图所示。点B剩余NaClO含量低于点A的原因是____。当m(NaClO)∶m(NH3)>7.6时,水体中总氮去除率反而下降,可能的原因是__________。
(4)电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用电解产生的活性原子将NO3-还原为N2,工作原理如题图所示。若阳极生成标准状况下2.24 L气体,理论上可除去NO3-的物质的量为_____mol。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是:①一个N≡N键断裂的同时,有3个H—H键断裂;②一个N
2NH3已达到平衡状态的是:①一个N≡N键断裂的同时,有3个H—H键断裂;②一个N![]() N键断裂的同时,有6个N—H键断裂;③其他条件不变时,混合气体平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤NH3%、N2%、H2%都不再改变;⑥恒温恒容时,密度保持不变;⑦正反应速率v(H2)=0.6 mol·(L·min)-1逆反应速率v(NH3)=0.4 mol·(L·min)-1。
N键断裂的同时,有6个N—H键断裂;③其他条件不变时,混合气体平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤NH3%、N2%、H2%都不再改变;⑥恒温恒容时,密度保持不变;⑦正反应速率v(H2)=0.6 mol·(L·min)-1逆反应速率v(NH3)=0.4 mol·(L·min)-1。
A.全部B.①③④⑤C.②③④⑤⑦D.①③⑤⑥⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com