
【题目】表示溶液中浓度的方法通常有两种:溶液中溶质的质量分数(w)和物质的量浓度(c),因此在配制溶液时,根据不同的需要,有不同的配制方法,请完成填空。
(1)用10%(密度为1.01 g·cm-3)的氢氧化钠溶液配制成27.5 g 2% 的氢氧化钠溶液。
①计算:需________g 10%(密度为1.01 g·cm3)的氢氧化钠溶液,其体积为________mL,需加________mL水(ρ水=1 g·cm-3)进行稀释。
②量取:用________mL量筒取10% 氢氧化钠,量取时视线要跟量筒________保持水平,然后倒入烧杯里,用________mL量筒量取蒸馏水也注入烧杯里。
③溶解:用________将上述溶液搅拌均匀,即得27.5 g 2% 的氢氧化钠溶液。
(2)用98%(密度为1.84 g·cm-3)的浓硫酸稀释成3 mol·L-1的稀硫酸100 mL,回答下列问题:
①需要取浓硫酸________mL;
②配制操作可分解成如下几步,以下正确的操作顺序是__________________________(填字母,下同)。
A.向容量瓶中注入少量蒸馏水,检查是否漏水
B.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C.用已冷却的稀硫酸注入已检查不漏水的容量瓶中
D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使溶液凹面恰好与刻度线相切
H.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线
(3)实验室需配制1 mol·L-1的氢氧化钠溶液和1 mol·L-1的硫酸溶液各100mL。
①要配制氢氧化钠溶液,在用托盘天平称取氢氧化钠固体时,天平读数为________。
A.4.0 g B.4.00 g C.>4.0 g
②在配制氢氧化钠溶液和硫酸溶液的各步操作中,有明显不同的是__________。
A.称量或量取 B.溶解或稀释 C.移液、洗涤 D.定容
【答案】5.5 5.4 22 10 凹液面最低处 25 玻璃棒 16.3 ADECBHGF C AB
【解析】
根据溶液稀释前后溶质的量不变,即浓硫酸溶液稀释的实验步骤进行分析解答;根据配制一定物质的量浓度溶液的步骤进行判断解答。
(1)①设需要10% 氢氧化钠溶液的质量为m,依据稀释前后溶质的质量不变,m×10%=27.5 g×2%,解得m=5.5 g,溶液的体积V=![]() ≈5.4 mL;需要水的质量为27.5 g-5.5 g=22 g,水的密度为1 g·mL-1,需水的体积为22.0 mL。答案:5.5;5.4;22;
≈5.4 mL;需要水的质量为27.5 g-5.5 g=22 g,水的密度为1 g·mL-1,需水的体积为22.0 mL。答案:5.5;5.4;22;
②量取5.4 mL溶液应选择10 mL量筒;量取22.0 mL水应选择25 mL量筒;读数时,量筒内液体凹液面最低处应与视线相切;答案:10;凹液面最低处;25;
③用玻璃棒搅拌使溶液混合均匀;答案:玻璃棒;
(2)①浓硫酸的物质的量浓度c=![]() =
=![]() =18.4 mol·L-1,依据稀释前后溶质的物质的量不变,设需要浓硫酸体积为V,则:V×18.4 mol·L-1=3mol·L-1×100 mL,解得V≈16.3 mL;答案:16.3;
=18.4 mol·L-1,依据稀释前后溶质的物质的量不变,设需要浓硫酸体积为V,则:V×18.4 mol·L-1=3mol·L-1×100 mL,解得V≈16.3 mL;答案:16.3;
②用浓溶液配制一定物质的量浓度稀溶液一般步骤为计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等,正确的顺序:ADECBHGF;答案:ADECBHGF;
(3)①配制100 mL 1 mol·L-1的氢氧化钠溶液所需的氢氧化钠的质量m=cVM=1mol·L-1×0.1 L×40 g·mol-1=4.0 g,但氢氧化钠称量时要放到烧杯里,故天平读数要大于4.0 g,故C符合题意;答案:C;
②用固体来配制溶液的步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶,用浓溶液来配制的步骤是计算、量取、稀释、移液、洗涤、定容、摇匀、装瓶,两者的区别是称量或量取,溶解或稀释;答案:AB。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下面是某课外活动小组在进行探究乙醇性质实验时遇到的问题,请你帮助解决。
(1)在做乙醇与钠反应的实验时,把一小块钠缓慢放入装有乙醇的试管内,与钠和水反应相比有所不同:①钠没有熔化成小球;②钠先沉在试管底;③反应后逐渐浮起。小组同学进行讨论,前两点现象解释达成共识。请说出你的看法:
①钠没有熔化成小球是因为_________________;
②钠先沉在试管底是因为__________________;
③第三点现象解释存在争议,活动小组的同学形成两种意见:a生成的氢气产生浮力所致;b生成的乙醇钠增大了溶液的密度所致。请你设计一个实验验证a和b说法的合理_________
(2)在做乙醇的催化氧化实验中,某同学有个意外发现:在酒精灯外焰上灼烧铜丝观察到铜丝表面变黑;当铜丝接近灯芯,变黑的铜丝又恢复原来的红色。请用化学方程式解释上述变化的过程_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以二氧化碳和氢气为原料制取乙醇的反应为2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) ΔH<0。某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示。下列说法正确的是
CH3CH2OH(g)+3H2O(g) ΔH<0。某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示。下列说法正确的是
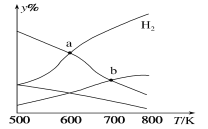
A.a点的平衡常数小于b点
B.b点,v正(CO2)=v逆(H2O)
C.a点,H2和H2O物质的量相等
D.其他条件恒定,充入更多H2,v(CO2)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是
A.乙醇和丙三醇互为同系物
B.环己烯(![]() )分子中的所有碳原子共面
)分子中的所有碳原子共面
C.分子式为C5H10O2,且属于酯的同分异构体共有9种(不考虑立体异构)
D.桥环烃二环[2,2,0](![]() )的二氯代物有6种结构(不考虑立体异构)
)的二氯代物有6种结构(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化亚铜(CuBr)微溶于水,不溶于乙醇,可用作有机合成中的催化剂。实验室中可利用无水硫酸铜、溴化钠为主要原料制备溴化亚铜,制备流程如下:

回答下列问题:
(1)过程①用到的玻璃仪器有烧杯、______,其中无水![]() 能否用蓝矾代替?做出判断,并说明理由:________。
能否用蓝矾代替?做出判断,并说明理由:________。
(2)制备CuBr的反应在装置乙中进行,向其中加入32gCuSO4和23g NaBr配制成的150mL水溶液,然后通入足量的SO2(部分夹持及加热装置已略去)。
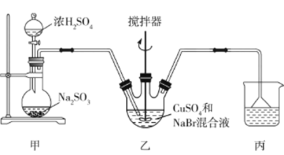
①装置甲中,不能采用浓度为98%的浓硫酸,一般采用浓度为70%左右的浓硫酸,其原因是________。
②写出装置乙中发生反应的离子方程式:_____,该反应需保持反应液在60℃,最佳加热方式为______,该装置中应用搅拌器搅拌的目的是______,Cu2+、Br-反应完毕的标志是______________。
③丙中倒扣的漏斗可防止液体倒吸,下列装置中不能防止液体倒吸的是________(填标号)。
a.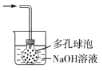 b.
b.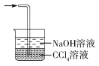 c.
c. d.
d.
(3)洗涤CuBr沉淀时采用SO2的水溶液而不采用蒸馏水,其目的是_____________。
(4)最后经洗涤、干燥得到21.6g产品,则该实验的产率是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
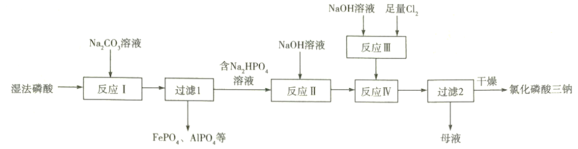
【题目】氯化磷酸三钠![]() 具有良好的灭菌、消毒、漂白作用。湿法磷酸由硫酸分解磷矿石得到,其中含Fe3+、Al3+等杂质。以湿法磷酸为原料制取氯化磷酸三钠的工艺流程如下:
具有良好的灭菌、消毒、漂白作用。湿法磷酸由硫酸分解磷矿石得到,其中含Fe3+、Al3+等杂质。以湿法磷酸为原料制取氯化磷酸三钠的工艺流程如下:
已知:a.温度高时,NaClO易分解。
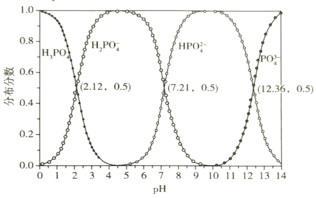
b.常温下,磷酸的物种分布分数与pH的关系如下图所示:
回答下列问题:
(1)硫酸分解Ca5(PO4)3F时产生的有毒气体主要是________________(填化学式)。
(2)反应Ⅰ中磷酸转化为钠盐,其钠盐再与Fe3+、Al3+作用形成沉淀。
①反应Ⅰ中发生多个反应,其中磷酸转化为Na2HPO4的主要离子方程式为___________,常温下应控制pH约为_____________________________。
②常温下,HPO![]() +Fe3+
+Fe3+![]() FePO4+H+的lgK为_________
FePO4+H+的lgK为_________![]() 。
。
(3)反应Ⅱ中不用Na2CO3溶液的原因是____________________________________________;
(4)反应Ⅲ的化学方程式为____________________________________________;
反应Ⅳ中两种溶液混合后需快速冷却,其目的是____________________________;
“母液”中的溶质有NaClO、_____________________(填2种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组利用反应 制取
制取![]() 溶液的实验装置如图所示(已知:
溶液的实验装置如图所示(已知: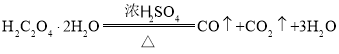 )下列说法正确的是( )
)下列说法正确的是( )
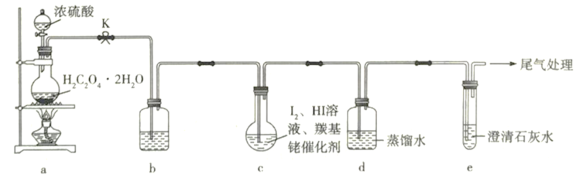
A.装置b中可盛放足量的浓![]() 溶液
溶液
B.装置c合适的加热方式是热水浴
C.反应后取少量装置c中溶液并滴加![]() 溶液,有黄色沉淀生成,说明
溶液,有黄色沉淀生成,说明![]() 被还原
被还原
D.若装置e中溶液未见浑浊,说明该实验条件下一定没有![]() 生成
生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:H2O(g)=H2(g)+![]() O2(g) △H= +241.8kJ/mol,H2(g)+
O2(g) △H= +241.8kJ/mol,H2(g)+![]() O2(g)=H2O(1) △H= -285.8kJ/mol
O2(g)=H2O(1) △H= -285.8kJ/mol
当1g水蒸气变为液态水时,其焓变为
A.△H= +4.4kJ/molB.△H= -4.4kJ/mol
C.△H= -2.44kJ/molD.△H= +2.44kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知(1)H2O(g) = H2O(l) ΔH1=-Q1 kJ·mol-1
(2)CH3OH(g) = CH3OH(l) △H2=-Q2 kJ·mol-1
(3)2CH3OH(g) +3O2(g) = 2CO2(g)+4H2O(g) △H3=-Q3 kJ·mol-1(Q1、Q2、Q3均大于0)若要使1mol液态甲醇完全燃烧,最后恢复到室温,其△H为
A.Q2- 0.5Q3-2Q1B.0.5Q3-Q2+2Q1C.Q3-2Q2+4Q1D.0.5(Q1+Q2+Q3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com