
【题目】已知热化学方程式:H2O(g)=H2(g)+![]() O2(g) △H= +241.8kJ/mol,H2(g)+
O2(g) △H= +241.8kJ/mol,H2(g)+![]() O2(g)=H2O(1) △H= -285.8kJ/mol
O2(g)=H2O(1) △H= -285.8kJ/mol
当1g水蒸气变为液态水时,其焓变为
A.△H= +4.4kJ/molB.△H= -4.4kJ/mol
C.△H= -2.44kJ/molD.△H= +2.44kJ/mol
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中发生下列反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡1.8倍,下列叙述正确的是
A.平衡向正反应方向移动B.A的转化率变大
C.D的物质的量变多D.a<c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表示溶液中浓度的方法通常有两种:溶液中溶质的质量分数(w)和物质的量浓度(c),因此在配制溶液时,根据不同的需要,有不同的配制方法,请完成填空。
(1)用10%(密度为1.01 g·cm-3)的氢氧化钠溶液配制成27.5 g 2% 的氢氧化钠溶液。
①计算:需________g 10%(密度为1.01 g·cm3)的氢氧化钠溶液,其体积为________mL,需加________mL水(ρ水=1 g·cm-3)进行稀释。
②量取:用________mL量筒取10% 氢氧化钠,量取时视线要跟量筒________保持水平,然后倒入烧杯里,用________mL量筒量取蒸馏水也注入烧杯里。
③溶解:用________将上述溶液搅拌均匀,即得27.5 g 2% 的氢氧化钠溶液。
(2)用98%(密度为1.84 g·cm-3)的浓硫酸稀释成3 mol·L-1的稀硫酸100 mL,回答下列问题:
①需要取浓硫酸________mL;
②配制操作可分解成如下几步,以下正确的操作顺序是__________________________(填字母,下同)。
A.向容量瓶中注入少量蒸馏水,检查是否漏水
B.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C.用已冷却的稀硫酸注入已检查不漏水的容量瓶中
D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使溶液凹面恰好与刻度线相切
H.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线
(3)实验室需配制1 mol·L-1的氢氧化钠溶液和1 mol·L-1的硫酸溶液各100mL。
①要配制氢氧化钠溶液,在用托盘天平称取氢氧化钠固体时,天平读数为________。
A.4.0 g B.4.00 g C.>4.0 g
②在配制氢氧化钠溶液和硫酸溶液的各步操作中,有明显不同的是__________。
A.称量或量取 B.溶解或稀释 C.移液、洗涤 D.定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用真空碳热还原冶炼镁、铝及锰的单质或合金是治金工业的热点之一。回答下列问题:
(1)已知体系自由能变化![]() 时反应能自发进行。
时反应能自发进行。![]() 真空碳热还原冶炼镁的主要反应为
真空碳热还原冶炼镁的主要反应为![]() ,其自由能变化与温度、压强的关系如图所示:
,其自由能变化与温度、压强的关系如图所示:

温度由低到高的顺序是_______________,![]() 时该反应不能自发进行的温度是_________(填“
时该反应不能自发进行的温度是_________(填“![]() ”“
”“![]() ”或“
”或“![]() ”)。
”)。
(2)![]() 提出的碳热还原
提出的碳热还原![]() 冶炼
冶炼![]() 的机理如下:
的机理如下:
(Ⅰ)![]()
(Ⅱ)![]()
(Ⅲ)![]()
则反应![]() 的
的![]() ______________
______________![]() (用含a、b、c的代数式表示);中间体之一
(用含a、b、c的代数式表示);中间体之一![]() 与
与![]() 反应可用于实验室制备甲烷,写出
反应可用于实验室制备甲烷,写出![]() 与
与![]() 反应的化学方程式:_________________________________________________________。
反应的化学方程式:_________________________________________________________。
(3)制备锰合金的相关反应及平衡时![]() 与温度的关系如图所示(
与温度的关系如图所示(![]() 为用分压表示的平衡常数,分压=总压×体积分数):
为用分压表示的平衡常数,分压=总压×体积分数):
(Ⅰ)![]()
(Ⅱ)![]()
(Ⅲ)![]()
①![]() 的反应是___________(填标号)。
的反应是___________(填标号)。
②![]() ____________[用
____________[用![]() 、
、![]() 表示];A点
表示];A点![]() ___________用[
___________用[![]() 表示]。
表示]。
③向某恒容密闭容器中充入![]() 并加入足量
并加入足量![]() ,若只发生反应:
,若只发生反应:![]() ,达到B点的平衡状态。达到平衡前,v(正)__________v(逆)(填“大于”“小于”或“等于”),达到平衡时,
,达到B点的平衡状态。达到平衡前,v(正)__________v(逆)(填“大于”“小于”或“等于”),达到平衡时,![]() _______________(保留小数点后两位)。
_______________(保留小数点后两位)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是重要的化工原料,以丙烯为原料合成有机玻璃和油墨材料DAP-A树脂的流程如下:

回答问题:
(1)写出下列物质可能的结构简式:B___________________,F________________________。
(2)写出反应类型:反应②___________________;反应③____________________________。
(3)1 mol DAP-A树脂在一定条件下与H2发生加成反应,最多消耗H2_______________mol。
(4)写出反应①的化学方程式_____________________________________________________。
(5)写出G在一定条件下与乙二醇发生反应生成一种高分子化合物的化学方程式为_______。
(6)E的同分异构体中,属于酯类的链状有机物有HCOOCH2CH=CH2、HCOOCH=CHCH3、___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
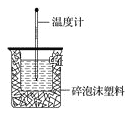
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是_______________,烧杯间填满碎泡沫塑料的作用是_________________。
(2)向盐酸中倒入NaOH溶液的正确操作是:________。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)大烧杯上如果不盖硬纸板,则求得的中和热 ________(填“偏大”、“偏小”或“无影响”)。
(4)两次实验记录的数据如下表:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
① | 50mL 0.55mol/L NaOH溶液 | 50mL 0.5mol/L HCl溶液 | 20℃ | 23.3℃ | |
② | 50mL 0.55mol/L NaOH溶液 | 50mL 0.5mol/L HCl溶液 | 20℃ | 23.4℃ | |
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18kJ/(℃·kg),各溶液的密度均为1g/cm3。则中和热ΔH=_________kJ·mol-1。
(5)若改用60mL 0.50mol·L-1 盐酸和50mL 0.55mol·L-1 NaOH溶液进行反应与上述实验相比,所放出的热量_______(填“相等”“不相等”),若实验操作均正确,则所求中和热__________(填“相等”“不相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气中SO2和NOx(NO及NO2)的脱除对于环境保护意义重大。
(1)湿式氨法烟气脱硫脱氮是通过氨水吸收烟气,得到含![]() 、
、![]() 、
、![]() 、
、![]() 和NO2的吸收液。
和NO2的吸收液。
①用离子方程式解释吸收液中含有![]() 的原因:_____________;
的原因:_____________;
②吸收液中的![]() 、
、![]() 均对NO2具有吸收作用,但
均对NO2具有吸收作用,但![]() 对NO2的吸收能力比
对NO2的吸收能力比![]() 弱,
弱,![]() 与NO2反应生成
与NO2反应生成![]() 的离子方程式是:___________;
的离子方程式是:___________;
(2)经测定,在烟气的吸收过程中,吸收液对NO2的吸收率随烟气通入量变化的曲线如下图所示。

结合化学用语解释产生上述结果的原因:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某柔性屏手机的柔性电池以碳纳米管做电极材料,以吸收![]() 溶液的有机高聚物做固态电解质,其电池结构如图所示。电池总反应为:
溶液的有机高聚物做固态电解质,其电池结构如图所示。电池总反应为:
![]()
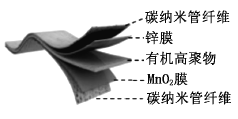
下列说法中,正确的是( )
A.充电时,![]() 移向Zn膜
移向Zn膜
B.充电时,含有![]() 膜的碳纳米管纤维一端连接有机高聚物电源负极
膜的碳纳米管纤维一端连接有机高聚物电源负极
C.放电时,电子由锌膜表面经有机高聚物至![]() 膜表面
膜表面
D.放电时,电池的负极反应为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用一定浓度的盐酸滴定某浓度的氨水。滴定终点附近溶液的pH和导电能力的变化如图所示(利用溶液导电能力的变化可判断滴定终点,溶液总体积变化忽略不计)。下列说法错误的是( )

A.a点对应的溶液中:![]()
B.a→b过程中,![]() 不断增大
不断增大
C.c→d溶液导电性增强的主要原因是![]() 和
和![]() 增大
增大
D.根据溶液pH和导电能力的变化可判断:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com