
【题目】50mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
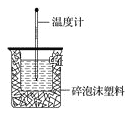
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是_______________,烧杯间填满碎泡沫塑料的作用是_________________。
(2)向盐酸中倒入NaOH溶液的正确操作是:________。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)大烧杯上如果不盖硬纸板,则求得的中和热 ________(填“偏大”、“偏小”或“无影响”)。
(4)两次实验记录的数据如下表:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
① | 50mL 0.55mol/L NaOH溶液 | 50mL 0.5mol/L HCl溶液 | 20℃ | 23.3℃ | |
② | 50mL 0.55mol/L NaOH溶液 | 50mL 0.5mol/L HCl溶液 | 20℃ | 23.4℃ | |
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18kJ/(℃·kg),各溶液的密度均为1g/cm3。则中和热ΔH=_________kJ·mol-1。
(5)若改用60mL 0.50mol·L-1 盐酸和50mL 0.55mol·L-1 NaOH溶液进行反应与上述实验相比,所放出的热量_______(填“相等”“不相等”),若实验操作均正确,则所求中和热__________(填“相等”“不相等”)。
【答案】环形玻璃搅拌棒 保温、隔热,减少实验过程中的热量损失 C 偏大 - 56.0 不相等 相等
【解析】
(1)为了使酸、碱快速混合,要使用环形玻璃搅拌棒;
(2)测定中和热要快速,减少热量损失;
(3)中和热关键是减少实验过程中的热量损失,要保温、隔热;
(4)根据Q=cm(t2-t1)计算出反应放出的热量,结合反应产生的水的物质的量,根据中和热定义计算出中和热;
(5)酸、碱反应,反应物的物质的量越多,反应放出的热量就越多;中和热是酸、碱反应产生1mol H2O所放出的热量。
(1)测定中和热,要使酸、碱快速混合,同时减少混合时的热量损失,要使用环形玻璃搅拌棒;
(2)中和热测定关键是减少反应过程的热量损失,向盐酸中倒入NaOH溶液的正确操作是:一次迅速倒入,故合理选项是C。
(3)大烧杯上如果不盖硬纸板,则会导致部分热量损失,产生等量的水,溶液温度升高的少,放出的热量减少,使得求得的中和热偏大;
(4)t1=20 ℃,t2=![]() =23.35℃;则反应过程中放出的热量Q=cm(t2-t1)=4.18 kJ/(℃·kg)×0.1kg×(23.35℃-20 ℃)=1.4003kJ,反应产生水的物质的量是n(H2O)= 0.5 mol/L×0.050L=0.0250mol,则中和热△H=-1.4003kJ÷0.0250mol=-56.0kJ/mol;
=23.35℃;则反应过程中放出的热量Q=cm(t2-t1)=4.18 kJ/(℃·kg)×0.1kg×(23.35℃-20 ℃)=1.4003kJ,反应产生水的物质的量是n(H2O)= 0.5 mol/L×0.050L=0.0250mol,则中和热△H=-1.4003kJ÷0.0250mol=-56.0kJ/mol;
(5)若改用60mL 0.50mol·L-1 盐酸和50mL 0.55mol·L-1 NaOH溶液进行反应,反应时酸过量,以不足量的NaOH溶液为标准计算,NaOH的物质的量比第一次反应HCl的物质的量多,则反应产生的水的物质的量就多,所放出的热量就比上次多,二者不相等;由于中和热是酸、碱发生中和反应产生1mol水时放出的热量,因此若实验操作均正确,则所求中和热相等。


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
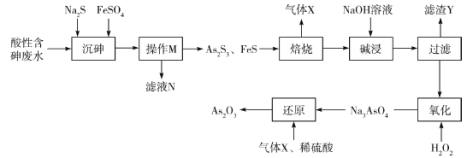
【题目】三氧化二砷(As2O3)可用于治疗急性早幼粒白血病。利用某酸性含砷废水(含![]() 、H+、
、H+、![]() )可提取三氧化二砷,提取工艺流程如下:
)可提取三氧化二砷,提取工艺流程如下:
已知:①常温下,![]() ;
;![]() 。
。
②As2O3+6NaOH=2Na3AsO3+3H2O。
③As2S3易溶于过量的Na2S溶液中,故加入FeSO4的目的是除去过量的S2-。
回答下列问题:
(1)操作M的名称是________,滤液N中含有的阳离子有Fe2+、H+、________。
(2)“焙烧”操作中,As2S3参与反应的化学方程式为____________。
(3)“碱浸”的目的是_____________,“滤渣Y”的主要成分是_____________(写化学式)。
(4)“氧化”中发生反应的离子方程式为___________________。
(5)该流程中可循环使用的物质是_________(写化学式),某次“还原”过程中制得了1.98kgAs2O3,则消耗标准状况下该物质的体积是________L。
(6)溶液中金属离子的除去方法之一是Na2S沉降法。常温下,若某溶液中含Fe2+、Ag+,且浓度均为0.1mol·L-1,则向该溶液中滴加稀Na2S溶液时,先生成的沉淀是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
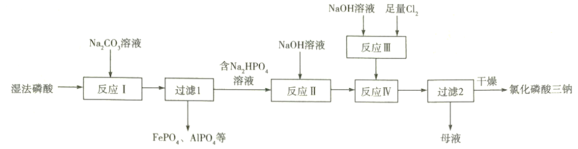
【题目】氯化磷酸三钠![]() 具有良好的灭菌、消毒、漂白作用。湿法磷酸由硫酸分解磷矿石得到,其中含Fe3+、Al3+等杂质。以湿法磷酸为原料制取氯化磷酸三钠的工艺流程如下:
具有良好的灭菌、消毒、漂白作用。湿法磷酸由硫酸分解磷矿石得到,其中含Fe3+、Al3+等杂质。以湿法磷酸为原料制取氯化磷酸三钠的工艺流程如下:
已知:a.温度高时,NaClO易分解。
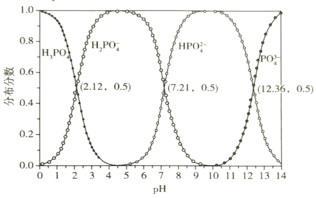
b.常温下,磷酸的物种分布分数与pH的关系如下图所示:
回答下列问题:
(1)硫酸分解Ca5(PO4)3F时产生的有毒气体主要是________________(填化学式)。
(2)反应Ⅰ中磷酸转化为钠盐,其钠盐再与Fe3+、Al3+作用形成沉淀。
①反应Ⅰ中发生多个反应,其中磷酸转化为Na2HPO4的主要离子方程式为___________,常温下应控制pH约为_____________________________。
②常温下,HPO![]() +Fe3+
+Fe3+![]() FePO4+H+的lgK为_________
FePO4+H+的lgK为_________![]() 。
。
(3)反应Ⅱ中不用Na2CO3溶液的原因是____________________________________________;
(4)反应Ⅲ的化学方程式为____________________________________________;
反应Ⅳ中两种溶液混合后需快速冷却,其目的是____________________________;
“母液”中的溶质有NaClO、_____________________(填2种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是
A. 用Na2S处理含Hg2+废水:Hg2+ + S2 = HgS↓
B. 燃煤中添加生石灰减少SO2的排放:2CaO + O2 + 2SO2 ![]() 2CaSO4
2CaSO4
C. 工业上将Cl2 通入石灰乳中制漂白粉:Cl2 + OH- = Cl-+ ClO- + H2O
D. 向漂白液中加入适量洁厕灵(含盐酸),产生氯气:ClO-+ Cl-+2H+ = Cl2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:H2O(g)=H2(g)+![]() O2(g) △H= +241.8kJ/mol,H2(g)+
O2(g) △H= +241.8kJ/mol,H2(g)+![]() O2(g)=H2O(1) △H= -285.8kJ/mol
O2(g)=H2O(1) △H= -285.8kJ/mol
当1g水蒸气变为液态水时,其焓变为
A.△H= +4.4kJ/molB.△H= -4.4kJ/mol
C.△H= -2.44kJ/molD.△H= +2.44kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是制铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)冶炼铜的反应为8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是_____(填元素符号)。
(2)上述冶炼过程中产生大量SO2。下列处理方案合理的是_____(填代号)
a.高空排放b.用于制备硫酸c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:![]() +2I-=2
+2I-=2![]() +I2
+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应的催化过程___、___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B. CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+2×283.0kJ/mol
C. 需要加热才能发生的反应一定是吸热反应
D. 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)![]() 2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L-1
其中正确的是:
A.①③B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物9,10-二甲基菲的结构如图所示,下列关于该物质的说法正确的是

A. 该物质分子式为C16H12
B. 该物质与甲苯互为同系物
C. 该物质能与溴水发生取代反应和加成反应
D. 该物质苯环上七氯代物的同分异构体有4种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com