
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B. CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+2×283.0kJ/mol
C. 需要加热才能发生的反应一定是吸热反应
D. 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
【答案】B
【解析】
A.强酸和强碱的稀溶液反应才能保证H+(aq)+OH-(aq)====H2O(l)中和热为-57.3 kJ·mol-1,H2SO4和Ca(OH)2得到的CaSO4微溶,会产生额外的热,故A错误;
B.在25℃,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热:CO(g)+1/2 O2(g)= CO2(g) ΔH=-283.0kJ/mol,再利用盖斯定律,得:2CO2(g)=2CO(g)+O2(g)![]() H=+2×283.0kJ/mol,故B正确;
H=+2×283.0kJ/mol,故B正确;
C.反应的吸、放热与反应条件无关,如有些放热反应必须在加热条件下才能进行,如铝热反应,故C错误;
D.燃烧热是1mol纯净物完全燃烧生成稳定的氧化物放出的热量,应生成液态水,D错误。答案选B。


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
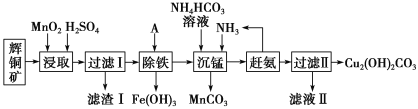
已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
②Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有____(任写一种)。
(2)滤渣I中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的化学方程式:____。
(3)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为____,若加 A 后溶液的 pH调为5,则溶液中 Fe3+的浓度为____mol/L。
(4)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:____。
(5)“赶氨”时,最适宜的操作方法是____。
(6)滤液Ⅱ经蒸发结晶得到的盐主要是____(写化学式)。
(7)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置探究Cl2和NO2在NaOH溶液中的反应,若通入适当比例的Cl2和NO2,即发生反应Cl2+2NO2+4NaOH=2NaNO3+2NaCl+2H2O。
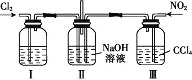
下列叙述正确的是
A. 实验室中用二氧化锰与3 mol·L-1的盐酸共热制备氯气
B. 装置Ⅰ中盛放的试剂是浓硫酸,作用是干燥氯气
C. 装置Ⅲ的作用是便于控制通入NO2的量
D. 若制备的NO2中含有NO,应将混合气体通入水中以除去NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.H2(g)+I2(g)2HI(g),其他条件不变,缩小反应容器体积,正逆反应速率不变
B.C(s)+H2O(g)H2(g)+CO(g),碳的质量不再改变说明反应已达平衡
C.若压强不再随时间变化能说明反应2A(?)+B(g)2C(?)已达平衡,则A、C不能同时是气体
D.1 mol N2和3 mol H2反应达到平衡时H2转化率为10%,放出的热量为Q1;在相同温度和压强下,当2 mol NH3分解为N2和H2的转化率为10%时,吸收的热量为Q2,Q2不等于Q1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿(含FeO·Cr2O3、Al2O3、SiO2等)为原料制备二草酸铬钾的实验步骤如图:
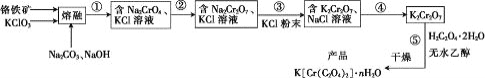
回答下列问题:
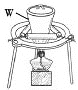
(1)“熔融”的装置如图,坩埚W的材质可以是________(填“铁”“陶瓷”或“玻璃”);FeO·Cr2O3与KClO3及Na2CO3发生反应,生成Fe2O3、KCl、Na2CrO4和CO2的化学方程式为_______________。
(2)熔融后的固体中含Na2CrO4、Fe2O3、Na2SiO3、NaAlO2、KCl等,步骤①的具体步骤为水浸,过滤,调pH为7~8,加热煮沸半小时,趁热过滤。第一次过滤滤渣中的主要成分为________,“调pH为7~8,加热煮沸半小时”的目的是__________。
(3)步骤②需加入酸,则加入稀硫酸时发生反应的离子方程式为________。
(4)步骤④包含的具体操作有____,经干燥得到K2Cr2O7晶体。(有关物质的溶解度曲线如图所示)
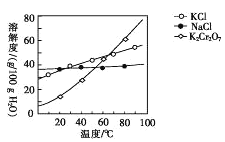
(5)步骤⑤需往两种固体混合物中加入一滴水及少量酒精研磨,所用的硅酸盐质仪器的名称是________。
(6)采用热重分析法测定K[Cr(C2O4)2]·nH2O样品所含结晶水数目,将样品加热到80℃时,失掉全部结晶水,失重16.8%。K[Cr(C2O4)2]·nH2O晶体中n=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定分数是指滴定过程中标准溶液与待测溶液中溶质的物质的量之比。用0.10 mol·L-1 NaOH溶液滴定0.10 mol·L1 H2C2O4(草酸)溶液的滴定曲线如图所示。下列说法不正确的是

A. H2C2O4属于二元弱酸
B. 若用NaOH标准溶液滴定NaHC2O4溶液,可用酚酞作指示剂
C. 图中①处:c(H2C2O4)+c(H+)=c(OH-)
D. 图中②处:c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在实验室制取乙酸乙酯的主要步骤如下:
①配制2mL浓硫酸、3mL乙醇(含18O)和2mL乙酸的混合溶液。
②按如图连接好装置并加入混合液,用小火均匀加热3~5min。
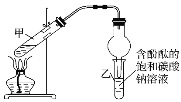
③待试管乙收集到一定量产物后停止加热,撤出试管乙用力振荡,然后静置待分层。
④分离出乙酸乙酯,洗涤、干燥。
回答问题:
(1)配制混合液的操作顺序是___。
(2)装置中球形干燥管,除起冷凝作用外,另一重要作用是___。
(3)步骤②安装好实验装置,加入药品前还应检查___。
(4)写出实验中加热试管的目的:①___;②___。
(5)反应中浓硫酸的作用是__;写出能表示18O位置的制取乙酸乙酯的化学方程式:___。
(6)上述实验中饱和碳酸钠溶液的作用是__。(填字母)
A.反应掉乙酸和乙醇
B.反应掉乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的更小,有利于分层析出
D.加速酯的生成,提高其产率
(7)步骤③所观察到的现象是___,从试管乙中分离出乙酸乙酯的实验操作名称是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用固体KOH配制0.1 mol/L的KOH溶液 480 mL,回答下列问题:
(1)配制过程中需要用到的玻璃仪器有______。
(2)需要用托盘天平称量______g KOH固体。
(3)如果在定容时仰视操作,则所配得溶液的浓度______0.1 mol/L(填>,=,<)。
(4)若所用的固体KOH中混有NaOH,则所配得溶液的c(OH-)浓度______0.1 mol/L (填>,=,<)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com