
����Ŀ������˵����ȷ����(����)
A.H2(g)��I2(g)2HI(g)�������������䣬��С��Ӧ������������淴Ӧ���ʲ���
B.C(s)��H2O(g)H2(g)��CO(g)��̼���������ٸı�˵����Ӧ�Ѵ�ƽ��
C.��ѹǿ������ʱ��仯��˵����Ӧ2A(��)��B(g)2C(��)�Ѵ�ƽ�⣬��A��C����ͬʱ������
D.1 mol N2��3 mol H2��Ӧ�ﵽƽ��ʱH2ת����Ϊ10%���ų�������ΪQ1������ͬ�¶Ⱥ�ѹǿ�£���2 mol NH3�ֽ�ΪN2��H2��ת����Ϊ10%ʱ�����յ�����ΪQ2��Q2������Q1
���𰸡�B
��������
A���ÿ��淴Ӧ�ķ�Ӧǰ������������������仯������С��Ӧ����������൱�ڼ�ѹ��ƽ�ⲻ�ƶ��������淴Ӧ����ͬ�ȳ̶����ӣ���A����
B���ڽ���ƽ��ǰ��̼���������ϸı䣬�ﵽƽ��ʱ���������䣬���̼���������ٸı���˵����Ӧ�Ѵ�ƽ�⣬��B��ȷ��
C����ѹǿ���ٸı�˵����Ӧ�ﵽƽ�⣬������Ӧǰ������ļ��������ȣ���A��C���ܾ�Ϊ���壬��C����
D����֪N2(g)+3H2(g)2NH3(g) ��H���ϳɰ���ʵ�ʲ��뷴Ӧn(H2)=3��10��=0.3mol�����Q1=![]() ��|��H|=0.1|��H|���ֽⰱ��ʱʵ�����ĵ�n(NH3)=2��10��=0.2mol��Q2=
��|��H|=0.1|��H|���ֽⰱ��ʱʵ�����ĵ�n(NH3)=2��10��=0.2mol��Q2=![]() ��|��H|=0.1|��H|����Q1=Q2����D����
��|��H|=0.1|��H|����Q1=Q2����D����
��ѡB��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϲ�����shikonin������ͼ���Ǵ�����������ѧ����Lithospermum erythrorhizon��һ��ֲ��ĸ�����ȡ�����ĺ�ɫ������������������������ҩ���������������Ƶ������˵ĸ�ҩ������˵������ȷ���ǣ� ��
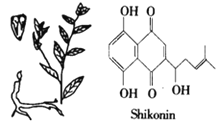
A. �ϲ����ķ���ʽΪC16H16O5
B. �������ϲ�����NaOH��Һ��Ũ��ˮ��Ӧ������NaOH��Br2 �����ʵ���֮��Ϊ3:4
C. �ϲ������ܷ���������Ӧ���ܷ�����ԭ��Ӧ
D. �������ϲ�����������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ñ�������������Ũ���������ط�Ӧ�����Ƶô���Ϊ98%��NO���䷴ӦΪFeSO4+KNO3+H2SO4(Ũ)![]() Fe2(SO4)3+NO��+K2SO4+H2O(δ��ƽ)�������й�˵������ȷ����
Fe2(SO4)3+NO��+K2SO4+H2O(δ��ƽ)�������й�˵������ȷ����
A. �÷�Ӧ����������KNO3
B. ���������뻹ԭ��������ʵ���֮��Ϊ2��3
C. Fe2(SO4)3��K2SO4��H2O�������
D. �÷�Ӧ������144gH2O��ת�Ƶ��ӵ����ʵ���Ϊ12mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Fe��Fe2O3��ɵ�3.84 g ������м���120 mLijŨ�ȵ����ᣬǡ����ȫ��Ӧ������672mLH2(��״����)������Ӧ�����Һ�е��뼸��KSCN��Һ����Һ���ʺ�ɫ������
(1)ԭ�������Fe2O3��Fe�������ֱ�Ϊ_______��________��
(2)ԭ��������ʵ���Ũ��Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ��2A(g) + 3B(g) ![]() 2C(g)+D(g)�������ֲ�ͬ�����µķ�Ӧ���ʷֱ�Ϊ��
2C(g)+D(g)�������ֲ�ͬ�����µķ�Ӧ���ʷֱ�Ϊ��
�٦�(A)=0.5mol��L-1��min-1 �ڦ�(B)=0.6 mol��L-1��min-1
�ۦ�=0.35 mol��L-1��min-1 �ܦ�(D)=0.4 mol��L-1��min-1
�÷�Ӧ�������ֲ�ͬ�����·�Ӧ�����ɿ쵽����˳����
A. �٢ڢۢ� B. �ڢ٢ܢ� C. �ܢ٢ڢ� D. �ڢܢ٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����Ȼ�ѧ��Ӧ����������ȷ����
A. HCl��NaOH��Ӧ���к�����H����57.3kJ/mol����H2SO4��Ca(OH)2��Ӧ���к�����H��2��(��57.3)kJ/mol
B. CO(g)��ȼ������283.0kJ/mol����2CO2(g) ��2CO(g)��O2(g)��Ӧ����H��+2��283.0kJ/mol
C. ��Ҫ���Ȳ��ܷ����ķ�Ӧһ�������ȷ�Ӧ
D. 1mol����ȼ��������̬ˮ�Ͷ�����̼���ų��������Ǽ����ȼ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼװ���еı仯�����������
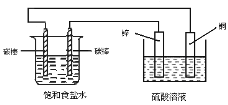
A.���Ӿ����ߴ�пƬ�����Ҳ�̼�����ٴ����̼������ͭƬ
B.ͭƬ�Ϸ���������Ӧ
C.�Ҳ�̼���Ϸ����ķ�Ӧ��2H++2e��H2 ��
D.ͭ�缫��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ʻ�����COS���㷺��������úΪԭ�ϵĸ��ֻ���ԭ������,����������ж�����ѧ��Ʒ�����½��ʹ�����Ⱦ��
��1���ʻ����ˮ�ⷴӦ����ⷴӦ�����ֳ��õ�����:
ˮ�ⷴӦ��COS��g��+H2O��g��![]() H2S��g��+CO2��g�� ��H=-34kJ/mol
H2S��g��+CO2��g�� ��H=-34kJ/mol
��ⷴӦ��COS��g��+H2��g�� ![]() H2S��g��+CO��g�� ��H=+7kJ/mol��
H2S��g��+CO��g�� ��H=+7kJ/mol��
��֪:2H2��g��+O2��g��=2H2O��g�� ��H=-484kJ/mol��
д����ʾCOȼ���ȵ��Ȼ�ѧ����ʽ:______________��
��2����ⷴӦ�ﵽƽ�������ϵ���¶Ⱥ���ѹǿ����,ͨ��������He,����Ӧ����____����������������С����������������ͬ��,COS��ת����_______��
��3��ij�¶���,�����Ϊ2L�ĺ����ܱ�������ͨ��2molCOS��g����4molH2O��g��������ˮ�ⷴӦ��5min��Ӧ�ﵽƽ�������COS��g����ת����Ϊ75%��
�ش���������:
�ٷ�Ӧ����ʼ��5min����v��H2S��=_______mol��L-1��min-1��
�ڸ��¶��£�����ˮ�ⷴӦ��ƽ�ⳣ��K=____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W ���������������ת����ϵ������ Y��Z Ϊ�����δ�г���Ӧ��������

��1����ʵ���Ҿ����ó���ʯ��ˮ������ X ��ȼ�ղ��W ����;֮һ�Ǽ����оƬ��W �����ڱ��е�λ��Ϊ ___________��Y ����;�� _________��д��Y��NaOH ��Һ��Ӧ�����ӷ���ʽ _________��
��2���� X��W Ϊ�ճ������г��������ֽ������� Y ��������ɫ�����Ϳ�ϣ���÷�Ӧ�Ļ�ѧ����ʽΪ___________��
��3���� X Ϊ����ɫ��ĩ��Y Ϊ�����г���Һ�壬��
��X �ĵ���ʽΪ _______________���÷�Ӧ�Ļ�ѧ����ʽΪ ____________�����ɵĻ�������������ѧ�������� ________________________��
�� �� 7.8 �� X ������ȫ��Ӧ��ת�Ƶĵ�����Ϊ ___________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com