
【题目】羰基硫(COS)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。
(1)羰基硫的水解反应和氢解反应是两种常用的脱硫方法:
水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H=-34kJ/mol
H2S(g)+CO2(g) △H=-34kJ/mol
氢解反应:COS(g)+H2(g) ![]() H2S(g)+CO(g) △H=+7kJ/mol。
H2S(g)+CO(g) △H=+7kJ/mol。
已知:2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol。
写出表示CO燃烧热的热化学方程式:______________。
(2)氢解反应达到平衡后,保持体系的温度和总压强不变,通入适量的He,正反应速率____(填“增大”“减小”或“不变”,下同),COS的转化率_______。
(3)某温度下,向体积为2L的恒容密闭容器中通入2molCOS(g)和4molH2O(g),发生水解反应,5min后反应达到平衡,测得COS(g)的转化率为75%。
回答下列问题:
①反应从起始至5min内,v(H2S)=_______mol·L-1·min-1。
②该温度下,上述水解反应的平衡常数K=____________。
【答案】 CO(g)+1/2O2(g)=CO2(g) △H=-283 kJ·mol-l 减小 不变 0.15 1.8
【解析】试题分析:本题考查盖斯定律和燃烧热表示的热化学方程式的书写,外界条件对化学反应速率和化学平衡的影响,化学反应速率和化学平衡常数的计算。
(1)将3个反应依次编号:
COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H=-34kJ/mol(①式)
H2S(g)+CO2(g) △H=-34kJ/mol(①式)
COS(g)+H2(g) ![]() H2S(g)+CO(g) △H=+7kJ/mol(②式)
H2S(g)+CO(g) △H=+7kJ/mol(②式)
2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol(③式)
应用盖斯定律,将①式-②式+③式![]() 得,CO(g)+
得,CO(g)+![]() O2(g)=CO2(g)ΔH=(-34kJ/mol)-(+7kJ/mol)+(-484kJ/mol)
O2(g)=CO2(g)ΔH=(-34kJ/mol)-(+7kJ/mol)+(-484kJ/mol)![]() =-283kJ/mol,则CO燃烧热的热化学方程式为:CO(g)+
=-283kJ/mol,则CO燃烧热的热化学方程式为:CO(g)+![]() O2(g)=CO2(g)ΔH=-283kJ/mol。
O2(g)=CO2(g)ΔH=-283kJ/mol。
(2)保持体系的温度和总压强不变,通入适量的He,容器体积变大,物质的量浓度变小,正反应速率减小,逆反应速率减小。该反应是反应前后气体分子数不变的反应,容器体积变大,即减小压强,平衡不移动,COS的转化率不变。
(3)用三段式,COS(g)+H2O(g)![]() H2S(g)+CO2(g)
H2S(g)+CO2(g)
n(起始)(mol)2 4 0 0
n(转化)(mol)2![]() 0.75=1.5 1.5 1.5 1.5
0.75=1.5 1.5 1.5 1.5
n(平衡)(mol)0.5 2.5 1.5 1.5
①υ(H2S)=![]() =0.15mol/(L·min)。
=0.15mol/(L·min)。
②水解反应的平衡常数K=![]() =
=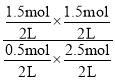 =1.8。
=1.8。


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】食用花生油中含有油酸,油酸是一种不饱和脂肪酸,对人体健康有益.其分子结构如图所示,下列说法不正确的是( )

A. 油酸的分子式为C18H34O2
B. 油酸可与氢氧化钠溶液发生中和反应
C. 1mol油酸可与2molH2发生加成反应
D. 1mol甘油可与3mol油酸发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10 g Mg、Al合金与足量100 mL NaOH溶液反应,产生H2的体积为6.72 L(标准状况下),求:
(1)合金中Al的质量分数;
(2)生成物NaAlO2的物质的量浓度(假设溶液体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸(H2A)在水中的电离方程式是H2A=H++HA-,HA-![]() H++A2-。
H++A2-。
(1)Na2A溶液显_________(填“酸性”“中性”或“碱性”)。理由是__________(用离子方程式表示)。
(2)已知0.1mol/L的NaHA溶液的pH=2,则0.1mol/L的H2A溶液中c(H+ )_______(填“<”“>”或“=”)0.11mol/L。
(3)在0.1mol/L的Na2A溶液中,下列微粒浓度关系式不正确的是__(填字母)。
A.c(A2- )+c(HA-)=0.1mol/L
B.c(OH-)=c(H+) +c(HA-)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-)
D.c(Na+)=2c(A2-)+2c(HA-)
(4)若向0.1mol/L的H2A溶液中加入等体积等浓度的NaOH溶液,则溶液中各离子浓度由大到小的顺序为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素是指其质量不到人体体重万分之一的元素。微量元素对体内正常代谢和健康起着重要作用。下列元素不属于微量元素的是
A. Fe B. I C. H D. F
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.金属晶体中一定含有金属键
B.在含有阳离子的化合物的晶体中,一定含有阴离子
C.金属的熔点和硬度由金属晶体中金属离子与自由电子间的作用强弱决定
D.Ti晶体中原子堆积方式为面心立方最密堆积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com