
【题目】某二元酸(H2A)在水中的电离方程式是H2A=H++HA-,HA-![]() H++A2-。
H++A2-。
(1)Na2A溶液显_________(填“酸性”“中性”或“碱性”)。理由是__________(用离子方程式表示)。
(2)已知0.1mol/L的NaHA溶液的pH=2,则0.1mol/L的H2A溶液中c(H+ )_______(填“<”“>”或“=”)0.11mol/L。
(3)在0.1mol/L的Na2A溶液中,下列微粒浓度关系式不正确的是__(填字母)。
A.c(A2- )+c(HA-)=0.1mol/L
B.c(OH-)=c(H+) +c(HA-)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-)
D.c(Na+)=2c(A2-)+2c(HA-)
(4)若向0.1mol/L的H2A溶液中加入等体积等浓度的NaOH溶液,则溶液中各离子浓度由大到小的顺序为__________________。
【答案】 碱性 A2-+H2O![]() HA-+OH- < C c(Na+)>c( HA- )>c(H+ )>c(A2- )>c(OH- )
HA-+OH- < C c(Na+)>c( HA- )>c(H+ )>c(A2- )>c(OH- )
【解析】试题分析:本题考查水解离子方程式的书写,溶液中粒子浓度的大小关系。
(1)由于H2A第一步为完全电离,第二步为部分电离,所以Na2A溶液中A2-只发生一步水解:A2-+H2O![]() HA-+OH-,Na2A溶液呈碱性。
HA-+OH-,Na2A溶液呈碱性。
(2)NaHA在水中的电离方程式为:NaHA=Na++HA-,HA-![]() H++A2-,0.1mol/LNaHA溶液的pH=2,溶液中c(H+)=0.01mol/L;H2A在水中的电离方程式为:H2A=H++HA-,HA-
H++A2-,0.1mol/LNaHA溶液的pH=2,溶液中c(H+)=0.01mol/L;H2A在水中的电离方程式为:H2A=H++HA-,HA-![]() H++A2-,0.1mol/LH2A溶液中第一步电离出的c(H+)=0.1mol/L,由于第一步电离产生的H+对第二步电离起抑制作用,所以0.1mol/LH2A溶液中c(H+)
H++A2-,0.1mol/LH2A溶液中第一步电离出的c(H+)=0.1mol/L,由于第一步电离产生的H+对第二步电离起抑制作用,所以0.1mol/LH2A溶液中c(H+)![]() 0.11mol/L。
0.11mol/L。
(3)由于H2A第一步为完全电离,第二步为部分电离,所以Na2A溶液中A2-只发生一步水解:A2-+H2O![]() HA-+OH-。A项,根据“A”守恒:c(A2-)+c(HA-)=0.1mol/L,正确;B项,溶液中的电荷守恒为:c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),物料守恒为:2[c(A2-)+c(HA-)]=c(Na+),整理得c(OH-)=c(H+)+c(HA-),正确;C项,溶液中的电荷守恒为:c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),错误;D项,溶液中的物料守恒为: c(Na+)= 2[c(A2-)+c(HA-)],正确;答案选C。
HA-+OH-。A项,根据“A”守恒:c(A2-)+c(HA-)=0.1mol/L,正确;B项,溶液中的电荷守恒为:c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),物料守恒为:2[c(A2-)+c(HA-)]=c(Na+),整理得c(OH-)=c(H+)+c(HA-),正确;C项,溶液中的电荷守恒为:c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),错误;D项,溶液中的物料守恒为: c(Na+)= 2[c(A2-)+c(HA-)],正确;答案选C。
(4)等体积等浓度的H2A溶液与NaOH溶液反应得NaHA溶液,在NaHA溶液中存在以下电离:NaHA=Na++HA-,HA-![]() H++A2-,H2O
H++A2-,H2O![]() H++OH-,HA-、H2O的电离都很微弱,但HA-的电离大于H2O的电离,所以溶液中离子浓度由大到小的顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)。
H++OH-,HA-、H2O的电离都很微弱,但HA-的电离大于H2O的电离,所以溶液中离子浓度由大到小的顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)。


科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.分子组成相差一个或几个CH2原子团的物质互为同系物
B.不带支链的烃,其分子都是直线形的
C.分子式为C4H10的烃有3种
D.甲烷是烷烃中碳的含量最低的,也是组成最简单的烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用无机矿物资源生产部分材料,其产品流程示意图如下:
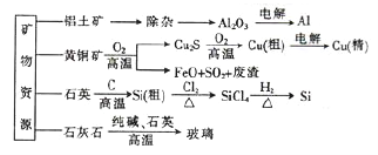
下列有关说法不正确的是
A. 制取粗硅时生成的气体产物为CO2
B. 生产铝、铜、高纯硅过程中涉及氧化还原反应
C. 黄铜矿冶炼铜时产生的副产物中,SO2可用于生产硫酸,FeO可用作冶炼铁的原料
D. 玻璃的生产工业属于硅酸盐工业,玻璃与水泥一样,主要成分都是硅酸盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。
(1)羰基硫的水解反应和氢解反应是两种常用的脱硫方法:
水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H=-34kJ/mol
H2S(g)+CO2(g) △H=-34kJ/mol
氢解反应:COS(g)+H2(g) ![]() H2S(g)+CO(g) △H=+7kJ/mol。
H2S(g)+CO(g) △H=+7kJ/mol。
已知:2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol。
写出表示CO燃烧热的热化学方程式:______________。
(2)氢解反应达到平衡后,保持体系的温度和总压强不变,通入适量的He,正反应速率____(填“增大”“减小”或“不变”,下同),COS的转化率_______。
(3)某温度下,向体积为2L的恒容密闭容器中通入2molCOS(g)和4molH2O(g),发生水解反应,5min后反应达到平衡,测得COS(g)的转化率为75%。
回答下列问题:
①反应从起始至5min内,v(H2S)=_______mol·L-1·min-1。
②该温度下,上述水解反应的平衡常数K=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.25g/mL,质量分数为36.5%的浓盐酸配置240mL 0.1mol/L的盐酸.浓盐酸的物质量浓度为多少?配置稀盐酸应取用的浓盐酸的体积为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾(K4[Fe(CN)6])俗称黄血盐,易溶于水和丙酮,是食盐的一种抗结剂,用含NaCN(N显-3价)的废液合成黄血盐的主要工艺流程如图:

(1)实验室用NaCN固体配制NaCN溶液时,应先将其溶于____溶液,再用蒸馏水稀释。
(2)在流程图“反应器”中发生的主要反应的方程式为_______________。
(3)流程中加入碳酸钠溶液主要目的是除去__________;
(4)相同温度下溶解度:Na4[Fe(CN)6]____K4[Fe(CN)6](选填>、<、=)。
(5)我国卫生部规定食盐中黄血盐最大使用量为10 mg/kg,黄血盐可与酸性高锰酸钾溶液反应:K4[Fe(CN)6]+KMnO4+H2SO4—KHSO4+Fe2(SO4)3+MnSO4+HNO3+CO2+H2O(未配平),若有1molK4[Fe(CN)6]被氧化,则消耗高锰酸钾的物质的量为____。
(6)电镀银时,电镀液不能直接用硝酸银溶液,可将其转变为K4[Ag2(CN)6]溶液,写出AgCl与黄血盐溶液制取电镀液的离子方程式_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com