
【题目】用无机矿物资源生产部分材料,其产品流程示意图如下:
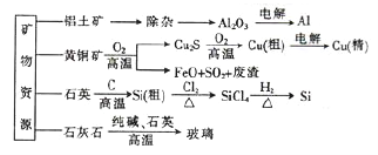
下列有关说法不正确的是
A. 制取粗硅时生成的气体产物为CO2
B. 生产铝、铜、高纯硅过程中涉及氧化还原反应
C. 黄铜矿冶炼铜时产生的副产物中,SO2可用于生产硫酸,FeO可用作冶炼铁的原料
D. 玻璃的生产工业属于硅酸盐工业,玻璃与水泥一样,主要成分都是硅酸盐
【答案】A
【解析】A.石英和碳在高温下反应生成硅和一氧化碳,不是二氧化碳,故A错误;B.电解熔融的氧化铝制取铝的反应是氧化还原反应,硫化亚铜在空气中煅烧生成铜和二氧化硫的反应是氧化还原反应,石英和碳在高温下反应生成硅和一氧化碳的反应属于氧化还原反应,故B正确;C. SO2可以转化成SO3,三氧化硫可以与水反应生成H2SO4;CO具有还原性,FeO与CO在高温下可生成Fe,因此副产物中的SO2可用于生产硫酸,FeO可用作冶炼铁,故C正确;D. 生产玻璃涉及到的反应有SiO2+Na2CO3 ![]() Na2SiO3+CO2↑和SiO2+CaCO3
Na2SiO3+CO2↑和SiO2+CaCO3 ![]() CaSiO3+CO2↑,属于硅酸盐工业,玻璃与水泥都是硅酸盐产品,主要成分都是硅酸盐,故D正确;故选A。
CaSiO3+CO2↑,属于硅酸盐工业,玻璃与水泥都是硅酸盐产品,主要成分都是硅酸盐,故D正确;故选A。


科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的数值,则下列说法中正确的是( )
A.44gCO2所含质子数为44NA个
B.常温常压,11.2L氧气含原子数为NA个
C.2.3g钠变为离子失电子数0.1NA
D.常温常压下,NA个氢原子的质量为2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到相应实验目的的是
选项 | 实验内容 | 实验目的 |
A | 将SO2通入紫色石蕊试液中,观察溶液是否褪色 | 验证有SO2有无漂白性 |
B | 用洁净的铂丝蘸取溶液进行焰色反应,火焰呈黄色 | 该溶液中一定含有钠盐 |
C | 常温下,测得浓度均为0.1mol/L溶液的pH:NaA>NaB | 证明常温下水解程度:A->B- |
D | 等体积、pH均为2的HA和HB两种酸分别与足量Zn反应,HA放出的H2多 | 证明HA是强酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,被还原的物质和被氧化的物质的物质的量之比最大的是
A. 铜和稀硝酸3Cu+8HNO3(稀)=2NO↑+3Cu(NO3)2+4H2O
B. 二氧化锰和浓盐酸 MnO2+4HC1(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
C. 二氧化氮和水3NO2+H2O=2HNO3+NO
D. 氯气和氨气3Cl2+8NH3=N2+6NH4C1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸(H2A)在水中的电离方程式是H2A=H++HA-,HA-![]() H++A2-。
H++A2-。
(1)Na2A溶液显_________(填“酸性”“中性”或“碱性”)。理由是__________(用离子方程式表示)。
(2)已知0.1mol/L的NaHA溶液的pH=2,则0.1mol/L的H2A溶液中c(H+ )_______(填“<”“>”或“=”)0.11mol/L。
(3)在0.1mol/L的Na2A溶液中,下列微粒浓度关系式不正确的是__(填字母)。
A.c(A2- )+c(HA-)=0.1mol/L
B.c(OH-)=c(H+) +c(HA-)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-)
D.c(Na+)=2c(A2-)+2c(HA-)
(4)若向0.1mol/L的H2A溶液中加入等体积等浓度的NaOH溶液,则溶液中各离子浓度由大到小的顺序为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外研究性学习小组拟用粗盐(含有少量杂质包括:泥沙、CaCl2、MgCl2、Na2SO4)经提纯后,配制0.4mol/L 450mL NaCl溶液.他们设计并实施了如下实验,请根据已学过的知识回答下列问题:
(1)取一定量的粗盐置于烧杯中加水溶解,所加的水量应为: . (填选项)
A.多加水配成较稀的溶液
B.加入适量的水至能溶解的固体溶解即止
(2)将(1)中配制的粗盐悬浊液过滤后取滤液加入过量的除杂试剂,如果除杂试剂可从下列六种溶液中选择 ①Na2CO3溶液 ②KOH溶液 ③AgNO3溶液 ④NaOH溶液 ⑤NaHCO3溶液 ⑥BaCl2溶液,则正确的试剂和加入的顺序应为 . (填选项,多选、少选、错选都不得分)
A.①②③B.②⑥⑤C.④⑥①D.①④⑥E.⑥①④F.⑥②⑤
将所得的悬浊液经过滤后取滤液加入足量的盐酸,充分反应后对混合溶液进行蒸发、过滤、洗涤、干燥操作,得到纯净的NaCl固体,请描述在蒸发操作过程中玻璃棒的作用是 .
(3)利用(2)中所得的NaCl固体继续配制所需溶液.在托盘天平上称量g NaCl固体.配制过程中需要使用的玻璃仪器有:烧杯、玻璃棒、和 .
(4)配制结束后同学们对实验中出现的某些错误操作,对最终配制的溶液浓度的影响进行了分析,则下列错误操作会导致最终配制溶液中NaCl的浓度相比0.4mol/L的偏差是:(填“偏大”、“偏小”、“无影响”)
①在上述(2)步中没有使用盐酸处理滤液,结果会 ,
②定容时俯视凹液面,结果会
③上下颠倒摇匀后液面低于刻度线,未及时加水至刻度线,结果会
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的判断正确的是( )
A. 60℃时,NaCl溶液的pH<7,则溶液呈酸性
B. 将pH=4的CH3COOH溶液加水稀释,溶液中所有离子的浓度均减小
C. 常温下,CH3COOH分子可能存在于pH>7的碱性溶液中
D. 相同温度下,1 mol·L-1氨水与0.5 mol·L-1氨水中c(OH-)之比是2∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com