
【题目】某柔性屏手机的柔性电池以碳纳米管做电极材料,以吸收![]() 溶液的有机高聚物做固态电解质,其电池结构如图所示。电池总反应为:
溶液的有机高聚物做固态电解质,其电池结构如图所示。电池总反应为:
![]()
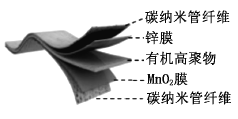
下列说法中,正确的是( )
A.充电时,![]() 移向Zn膜
移向Zn膜
B.充电时,含有![]() 膜的碳纳米管纤维一端连接有机高聚物电源负极
膜的碳纳米管纤维一端连接有机高聚物电源负极
C.放电时,电子由锌膜表面经有机高聚物至![]() 膜表面
膜表面
D.放电时,电池的负极反应为:![]()
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是
A.乙醇和丙三醇互为同系物
B.环己烯(![]() )分子中的所有碳原子共面
)分子中的所有碳原子共面
C.分子式为C5H10O2,且属于酯的同分异构体共有9种(不考虑立体异构)
D.桥环烃二环[2,2,0](![]() )的二氯代物有6种结构(不考虑立体异构)
)的二氯代物有6种结构(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:H2O(g)=H2(g)+![]() O2(g) △H= +241.8kJ/mol,H2(g)+
O2(g) △H= +241.8kJ/mol,H2(g)+![]() O2(g)=H2O(1) △H= -285.8kJ/mol
O2(g)=H2O(1) △H= -285.8kJ/mol
当1g水蒸气变为液态水时,其焓变为
A.△H= +4.4kJ/molB.△H= -4.4kJ/mol
C.△H= -2.44kJ/molD.△H= +2.44kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B. CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+2×283.0kJ/mol
C. 需要加热才能发生的反应一定是吸热反应
D. 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验淀粉的水解情况,某同学设计了以下三个实验方案,并根据实验现象,得出相应的结论:
甲:淀粉液![]() 水解液
水解液![]() 溶液变蓝 实验结论:淀粉未水解。
溶液变蓝 实验结论:淀粉未水解。
乙:淀粉液![]() 水解液
水解液![]() 无银镜现象 实验结论:淀粉未水解。
无银镜现象 实验结论:淀粉未水解。
丙:淀粉液![]() 水解液
水解液![]() 中和液
中和液![]() 生成银镜 实验结论:淀粉完全水解。
生成银镜 实验结论:淀粉完全水解。
根据上述三个方案的操作及现象,首先回答结论是否正确,然后简要说明理由。如果三个结论均不正确,请另设计一个方案来证明淀粉已经水解完全了。
(1)方案甲:__。
(2)方案乙:__。
(3)方案丙:__。
(4)你的方案:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)![]() 2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L-1
其中正确的是:
A.①③B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知(1)H2O(g) = H2O(l) ΔH1=-Q1 kJ·mol-1
(2)CH3OH(g) = CH3OH(l) △H2=-Q2 kJ·mol-1
(3)2CH3OH(g) +3O2(g) = 2CO2(g)+4H2O(g) △H3=-Q3 kJ·mol-1(Q1、Q2、Q3均大于0)若要使1mol液态甲醇完全燃烧,最后恢复到室温,其△H为
A.Q2- 0.5Q3-2Q1B.0.5Q3-Q2+2Q1C.Q3-2Q2+4Q1D.0.5(Q1+Q2+Q3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

(1)通过计算,可知系统(I)和系统(II)制氢的热化学方程式分别为__________________ 、______________________,制得等量H2所需能量较少的是___________。
(2)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g)。在610K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率a1=_____ %,反应平衡常数K =___________。
②在620K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率a2 _____________a1,该反应的H __________0。(填“>” “<” 或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是 _____ (填标号)。
A.H2S B.CO2 C.COS D.N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是
A.甲烷的燃烧热△H = -890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g) + 2O2(g)═ CO2(g) + 2H2O(g) △H = -890.3kJ/mol
B.一定条件下,将0.5mol N2和1.5m01H2置于密闭容器中充分反应生成NH3放热19.3kJ其热化学方程式为:N2(g) + 3H2(g)![]() 2NH3(g) △H =-38.6kJ/mol
2NH3(g) △H =-38.6kJ/mol
C.在l01kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g) + O2(g)═2H2O(l) △H =-571.6kJ/mol
D.HCl和NaOH反应的中和热△H = -57.3kJ/mol,则H2SO4和Ca(OH)2反应的反应热△H = 2×(-57.3)kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com