
【题目】如图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

(1)通过计算,可知系统(I)和系统(II)制氢的热化学方程式分别为__________________ 、______________________,制得等量H2所需能量较少的是___________。
(2)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g)。在610K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率a1=_____ %,反应平衡常数K =___________。
②在620K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率a2 _____________a1,该反应的H __________0。(填“>” “<” 或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是 _____ (填标号)。
A.H2S B.CO2 C.COS D.N2
【答案】H2O(l)=H2(g)+ 1/2O2(g) △H=+286 kJ/mol H2S(g)= H2(g)+S(s)△H=+20 kJ/mol 系统( II ) 2.5 2.8×10-3 > > B
【解析】
(1)系统中(I)最终是水分解制取氢气,系统(I)最终是H2S分解为硫和氢气。利用盖斯定律,依据反应①H2SO4(aq)=SO2(g)+ H2O(l)+![]() O2(g) △H1 =+327 kJ/mol、 ②SO2 (g)+I2(s)+2H2O(l) =2HI(aq)+ H2SO4(aq) △H2=-151kJ/mol、③2HI(aq)=H2(g)+I2(s)△H3=+110 kJ/mol、④H2S(g) + H2SO4(aq)= S(s)+ SO2(g) +2H2O(l) △H4=+61 kJ/mol,将上述反应进行如下变形:①十②+③,整理可得系统( I )的热化学方程式为H2O(l)=H2(g)+-O2(g) △H=+286 kJ/mol;②+③+④,整理可得系统( II )的热化学方程式为H2S(g)= H2(g)+S(s)△H=+20 kJ/mol;
O2(g) △H1 =+327 kJ/mol、 ②SO2 (g)+I2(s)+2H2O(l) =2HI(aq)+ H2SO4(aq) △H2=-151kJ/mol、③2HI(aq)=H2(g)+I2(s)△H3=+110 kJ/mol、④H2S(g) + H2SO4(aq)= S(s)+ SO2(g) +2H2O(l) △H4=+61 kJ/mol,将上述反应进行如下变形:①十②+③,整理可得系统( I )的热化学方程式为H2O(l)=H2(g)+-O2(g) △H=+286 kJ/mol;②+③+④,整理可得系统( II )的热化学方程式为H2S(g)= H2(g)+S(s)△H=+20 kJ/mol;
答案为:H2O(l)=H2(g)+1/2O2(g)△H=+286 kJ/mol;H2S(g)= H2(g)+S(s)△H=+20 kJ/mol;系统( II );
(2)①由题意设H2S转化的物质的量为x,
H2S(g)+CO2(g)![]() COS(g)+H2O(g)
COS(g)+H2O(g)
起始(mol)0.40 0.10 0 0
转化(mol) x x x x
平衡(mol)0.40-x 0.10-x x x
已知反应平衡后水的物质的量分数为0.02,则 ![]() =0.02,解得x=0.01,故H2S的平衡转化率a1=
=0.02,解得x=0.01,故H2S的平衡转化率a1=![]() ×100%=2.5%;反应平衡常数K=
×100%=2.5%;反应平衡常数K=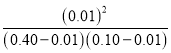 ≈2.8×10-3;
≈2.8×10-3;
答案为:2.5;2.8×10-3;
②水的物质的量分数增大,说明升高温度平衡正向移动,则H2S的转化率a2>a1,且正反应吸热,即△H>0;
答案为:> ;>;
③A.充入H2S,浓度增大,平衡正向移动,H2S的转化率减小,故A错误;
B.充入CO2,平衡正向移动,H2S的转化率增大,故B正确;
C.充入COS ,平衡逆向移动,H2S的转化率减小,故C错误;
D.充入N2,平衡不移动,H2S的转化率不变,故D错误;
答案选B。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]碳及其化合物广泛存在于自然界中,回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用___________形象化描述。在基态原子中,核外存在______对自旋相反的电子。
(2)碳在形成化合物时,其键型以共价键为主,原因是_____________。
(3)CS2分子中,共价键的类型有_____________,C原子的杂化轨道类型是_______,写出两个与CS2具有相同空间构型和键合形式的分子或离子_______________。
(4)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于_____晶体。
碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:

①在石墨烯晶体中,每个C原子连接_____个六元环,每个六元环占有___个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接________个六元环,六元环中最多有________个C原子在同一平面。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36gcm-3.实验室制备少量1-溴丙烷的主要步骤如下:
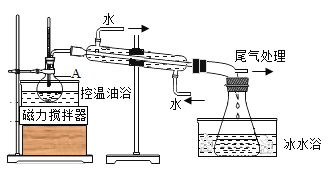
步骤1:在仪器A中加入搅拌磁子、12g正丙醇及20mL水,冰水冷却下缓慢加入28mL浓H2SO4;冷却至室温,搅拌下加入24gNaBr。
步骤2:如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止。
步骤3:将馏出液转入分液漏斗,分出有机相。
步骤4:将分出的有机相转入分液漏斗,依次用12mLH2O、12mL5%Na2CO3溶液和12mLH2O洗涤,分液,得粗产品,进一步提纯得1-溴丙烷。
(1)步骤1发生反应的方程式为______
(2)仪器A的名称是______;加入搅拌磁子的目的是搅拌和______。
(3)反应时生成的主要有机副产物有______。
(4)反应过程中可以观察到A的上方出现红棕色气体,其电子式为______。
(5)步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是______。同时可以观察到的现象是______。
(6)步骤4中三次洗涤分别洗去的主要杂质是①______②______③______。
(5)步骤4中②的Na2CO3溶液还可以用下列哪个试剂代替______
A. NaOH溶液 B. NaI溶液 C. Na2SO3溶液 D. CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学侯德榜改革国外的纯碱生产工艺,生产流程如图所示,下列说法不正确的是( )

A. 在沉淀池中应先通入氨气,再通入二氧化碳气体
B. 该反应原理: NH3+CO2+H2O=HCO3-+NH4+
C. 循环1中X是二氧化碳
D. 在过滤后的母液中加入氯化钠粉末、通入氨气,搅拌,经冷却结晶后可得氯化铵晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用容量瓶配制一定物质的量浓度的NaCl溶液的实验中,会使所配溶液浓度偏高的是
A. 称量NaCl固体时砝码上有杂质
B. 没有洗涤溶解NaCl固体的烧杯和玻璃棒
C. 定容时加水加多了,用滴管吸出溶液至刻度线
D. 定容时仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 天然气和沼气的主要成分都是甲烷,它们都属于不可再生能源
B. 煤的气化和液化均属于物理变化
C. 石油裂解的目的是为了得到更多的汽油
D. 用含糖类、淀粉比较多的农作物为原料,在催化剂作用下,经水解和细菌发酵制乙醇的过程属于生物质能的利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究绿色固体X(含四种元素)的组成和性质,设计并完成如下实验:
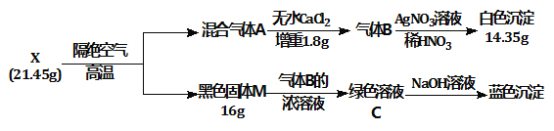
请回答:
(1) X的化学式是________。
(2) 绿色溶液C蒸干灼烧得到固体M,总反应的化学方程式是___________________________。
(3) 加热条件气体B能与氧气发生置换反应,写出该反应的化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁钉在氯气中被锈蚀为棕黄色物质FeCl3,而在盐酸中生成浅绿色的FeCl2溶液。则在Cl2、Cl-、H+中,具有氧化性的是__,其中氧化性最强的是___。
(2)盐酸在不同的反应中,可以分别表现出酸性、氧化性和还原性。现有如下三个反应,请写出盐酸在三个反应中,分别起何种作用:
①Zn+2HCl=ZnCl2+H2↑__;
②2HCl![]() H2↑+Cl2↑__。
H2↑+Cl2↑__。
(3)化学实验中,如使其步骤中的有害产物作为另一步骤的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如图中:
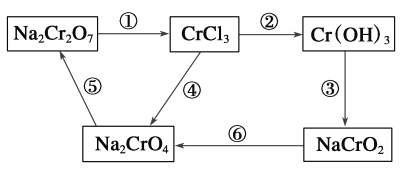
①在上述有编号的步骤中,需用还原剂的是__,需用氧化剂的是___。(填编号)
②完成步骤①的化学方程式,标出电子转移的方向和数目:
Na2Cr2O7+6KI+14HCl=2CrCl3+2NaCl+6KCl+3I2+___。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:

(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式:________________________。
(2)固体混合物A的组成为 、 。
(3)操作A的名称为_______________。
(4)若银铜合金中铜的质量分数为64%,理论上5.0 kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0 molL—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是 、 、过滤、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com