
【题目】NH3作为重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。
(1)氨的催化氧化反应:4 NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H< 0,是制硝酸的基础反应,在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
4NO(g)+6H2O(g) △H< 0,是制硝酸的基础反应,在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
浓度 时间 | C(NH3) mol/L | C(O2) mol/L | C(NO) mol/L |
第0 min | 0.8 | 1.6 | 0 |
第1 min | a | 1.35 | 0.2 |
第2 min | 0.3 | 0.975 | 0.5 |
第3 min | 0.3 | 0.975 | 0.5 |
第4 min | 0.7 | 1.475 | 0.1 |
①反应在第1min到第2min时,NH3的平均反应速率为______________。
②反应在第3 min时改变了条件,改变的条件可能是___________(填序号)。
A.使用催化剂 B.减小压强 C.升高温度 D.增加O2的浓度
③说明4NH3(g)+5O2(g)![]() 4NO(g)+6 H2O(g)达到平衡状态的是____(填序号)。
4NO(g)+6 H2O(g)达到平衡状态的是____(填序号)。
A.单位时间内生成n mol NO的同时生成n mol NH3
B.百分含量w(NH3)=w(NO)
C.反应速率v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6
D.在恒温恒容的容器中,混合气体的平均相对分子质量不再变化
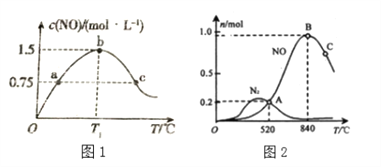
(2)若在容积为2L的密闭容器中充入4.0molNH3(g)和5.0molO2(g),发生如下反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),保持其他条件不变,在相同的时间内测得c(NO)与温度的关系如下图1所示。则 T1℃下,NH3的平衡转化率为______。
4NO(g)+6H2O(g),保持其他条件不变,在相同的时间内测得c(NO)与温度的关系如下图1所示。则 T1℃下,NH3的平衡转化率为______。
(3)氨催化氧化时会发生两个竞争反应,分别为
反应I:4NH![]() 4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
反应II: 4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1。
2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1。
为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如上图2:
①该催化剂在低温时选择反应_______(填“ I ”或“ II”)。
②C点比B点所产生的NO的物质的量少的主要原因______________________________。(4)通过以上两个竞争反应写出NO分解生成N2与O2的热化学方程式________________。
【答案】 0.3mol/(L·min) C AD 75% II 该反应为放热反应,当温度升高,平衡向左(逆反应)移动 2NO(g)![]() N2(g) +O2(g) △H= -180.8 kJ·mol-1
N2(g) +O2(g) △H= -180.8 kJ·mol-1
【解析】(1)①在第1min到第2min时,O2的平均反应速率=(1.35 mol/L-0.975 mol/L)/1 min=0.375 mol/(L·min), NH3的平均反应速率为氧气平均速率的4/5,则NH3的平均反应速率为0.375 mol/(L·min)×4/5=0.3mol/(L·min);由数据分析可知,反应在第3 min到4 min时,速率加快且反应逆向移动,又因此反应正反应是放热反应,故只有升高温度才满足条件。因为催化剂不影响平衡移动;减小压强,速率减慢;增加O2的浓度,平衡向正方向移动,均不符合实验数据得出的结论。故只有升高温度。③A.单位时间内生成n mol NO的同时生成n mol NH3,速率相等,方向相反,达到平衡,A正确;B.百分含量w(NH3)=w(NO),不一定达到平衡,故B错误;C.反应速率比等于计量数比,不一定达到平衡,故C错误;D.在恒温恒容的容器中,气体质量不变,反应前后气体分子数是变化量,当气体分子数不变,则混合气体的平均相对分子质量不再变化,说明反应达到平衡,故D正确,答案选AD。(2)因NO与NH3的计量数相等,T1℃时,c(NO)=1.5mol/L,则氨气的转化浓度为1.5mol/L,则 T1℃下,NH3的平衡转化率为1.5mol/L /2.0mol/L==75%。(3)①由图2分析可知,催化剂在低温时生成氮气比一氧化氮的量多,故催化剂在低温时选择反应II为主; ②该反应为放热反应,当温度升高,平衡向左(逆反应)移动,C点比B点所产生的NO的物质的量少;(4)由盖斯定律可知,(反应 II-反应I)/2,即得到NO分解生成N2与O2的方程式,则NO分解生成N2与O2的热化学方程式:2NO(g)![]() N2(g) +O2(g) △H= -180.8 kJ·mol-1。
N2(g) +O2(g) △H= -180.8 kJ·mol-1。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 1 mol NaHSO4熔融或溶于水时电离出的离子总数均为3NA
B. 17 g H2O2含有0.5NA个非极性共价键
C. 在1L0.5mol/LH2SO4溶液中,含有的氧原子数为2NA
D. 标准状况下,22.4 L Cl2溶于水转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯可用于合成杀除根瘤线虫的农药(分子式为C3H5Br2Cl)和应用广泛的DAP树脂: 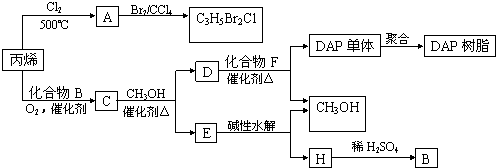
已知酯与醇可发生如下酯交换反应:
RCOOR′+R″OH ![]() RCOOR″+R′OH (R、R′、R″代表烃基)
RCOOR″+R′OH (R、R′、R″代表烃基)
(1)农药分子C3H5Br2Cl中每个碳原子上均连有卤原子. ①A的结构简式是 , A含有的官能团名称是;
②由丙烯生成A的反应类型是 .
(2)A水解可得到D,该水解反应的化学方程式是 .
(3)C蒸气密度是相同状态下甲烷密度的6.25倍,C中各元素的质量分数分别为:碳60%,氢8%,氧32%.C的结构简式是 .
(4)下列说法正确的是(选填序号字母) . a.C能发生聚合反应、还原反应和氧化反应
b.C含有2个甲基的羧酸类同分异构体有4个
c.D催化加氢的产物与B具有相同的相对分子质量
d.E具有芳香气味,易溶于乙醇
(5)E的水解产物经分离最终得到甲醇和B,二者均可循环利用于DAP树脂的制备.其中将甲醇与H分离的操作方法是 .
(6)F的分子式为C10H10O4 . DAP单体为苯的二元取代物,且两个取代基不处于对位,该单体苯环上的一溴取代物只有两种.D和F反应生成DAP单体的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在市场上洗衣粉多为加酶洗衣粉,即在洗衣粉中加入少量的碱性蛋白酶,它的催化活性很强,衣物的汗渍、血迹及人体排放的蛋白质油渍遇到它,皆能水解而除去,下列衣料中不能用加酶洗衣粉洗涤的是( )
A.棉织品
B.毛织品
C.腈纶织品
D.蚕丝织品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用反应![]() 可制备CuSO4溶液,且反应简便无污染,若将该反应设计为原电池,其正极电极反应式为_____________________。
可制备CuSO4溶液,且反应简便无污染,若将该反应设计为原电池,其正极电极反应式为_____________________。
(2)工业上由黄铜矿(主要成分CuFeS2)冶炼铜的过程中会产生二氧化硫气体和固体熔渣混合物,用稀H2SO4浸泡熔渣,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在Fe3+,检验溶液中是否存在Fe2+的最好的方法是_________________________(用化学反应方程式或离子方程式说明)。
(3)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是_______________。
a.电能全部转化为化学能 b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动 d.利用阳极泥可回收Ag、Pt、Au等金属
(4)用惰性电极电解CuSO4溶液,若只有阳极产生气体,则所得溶液的pH_______(填变大、变小、不变,不考虑溶液体积变化),要使电解质溶液恢复到电解前的状态,可加入____________;若阴阳两极均有气体生成,要使电解质恢复到电解前的状态,可加入__________,当加入该物质1mol即恢复到电解前状态,则电解时电路中转移电子的物质的量为__________摩尔。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各种糖类物质中,既存在于动物细胞内又存在于植物细胞内的是
A. 淀粉和核糖 B. 葡萄糖、核糖和麦芽糖
C. 核糖、脱氧核糖和葡萄糖 D. 糖原、乳糖、蔗糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为2L的密闭容器中,1mol X和3mol Y进行反应:X(g)+3Y(g)2Z(g),经12s达到平衡,生成0.6mol Z.下列说法正确的是( )
A.以X浓度变化表示的反应速率为 ![]() mol(Ls)
mol(Ls)
B.12s后将容器体积扩大为10L,Z的平衡浓度变为原来的 ![]()
C.若增大X的浓度,则物质Y的转化率减小
D.若该反应的△H<0,升高温度,平衡常数K减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. 核酸中的N存在于碱基中,蛋白质中的N存在氨基中
B. Na、Fe元素既不属于大量元素也不属于微量元素
C. 在细胞中,C元素的含量最多,是构成细胞的最基本元素
D. 等质量的脂肪中C、H的含量较糖类高,故彻底氧化分解产生能量多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com