
【题目】常温下,0.1mol/L CH3COONa溶液pH=9,则下列说法正确的是( )
A.加入少量NaOH固体后溶液pH小于9
B.加水稀释,CH3COONa水解程度增大,c(OH﹣)增大
C.该溶液水电离出的c(OH﹣)═10﹣9
D.CH3COOH在常温下Ka数值约为1×10﹣5
【答案】D
【解析】解:A、加入NaOH固体后c(OH﹣)增大,则pH变大,即大于9,故A错误;
B、盐溶液越稀越水解,故加水稀释,CH3COONa水解程度增大,但由于溶液体积增大,故c(OH﹣)减小,故B错误;
C、在盐溶液中,氢氧根和氢离子全部来自于水的电离,但由于CH3COO﹣将水电离出的氢离子结合,故溶液中的氢氧根是水电离出的全部,而pH=9时,溶液中的c(OH﹣)═10﹣5 , 即水电离出的c(OH﹣)═10﹣5 , 故C错误;
D、醋酸平衡常数Ka需要水解平衡常数计算,CH3COO﹣+H2OCH3COOH+OH﹣ , Kh= ![]() =
= ![]() =
= ![]() =
= ![]() ,故解得Ka=10﹣5 , 故D正确;故选D.
,故解得Ka=10﹣5 , 故D正确;故选D.
【考点精析】通过灵活运用弱电解质在水溶液中的电离平衡,掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理即可以解答此题.


科目:高中化学 来源: 题型:
【题目】某学生使用托盘天平称食盐时,错误的将食盐放在右托盘,而把砝码放在左托盘,称得食盐的质量为15.5g(1g以下只能使用游码)。.如果按正确的方法,食盐的质量应为
A. 15.5g B. 15.0g C. 14.5g D. 14.0g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图象正确的是( )
A.
反应的正方向放热(t1时升温)
B.
SO2气体通入氯水中
C.
NaOH溶液滴加Ca(HCO3)2溶液中
D.
将PH相同的NH4Cl溶液和稀盐酸稀释时PH的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置正确且能达到实验目的是( )
A.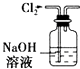 用如图所示装置除去Cl2中含有的少量HCl
用如图所示装置除去Cl2中含有的少量HCl
B.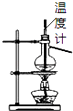 如图所示为石油分馏
如图所示为石油分馏
C.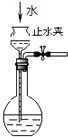 如图所示为检查装置气密性
如图所示为检查装置气密性
D.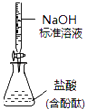 如图所示为测定未知盐酸的浓度
如图所示为测定未知盐酸的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)26H2O]是分析化学中重要的试剂,学习小组探究其分解产物.
(1)甲组按照图1所示的装置进行实验,关闭止水夹并加热A中的硫酸亚铁铵固体至分解完全,检验其分解产物. 
①装置B仪器名称是 , 所放试剂是 .
②装置C中可观察到的现象是 , 由此可知硫酸亚铁铵的分解产物中有 . (写化学式)
(2)乙组选用甲组实验中的装置A和图2所示的装置进行实验验证硫酸亚铁铵分解的产物中还有SO2和SO3 . ①乙组同学的实验装置中,依次连接的合理顺序(用装置的字母表示)为A、;取适量硫酸亚铁铵固体于A中,通入一段时间N2后,关闭止水夹再点燃酒精灯,通入N2的目的是 .
②装置H中有白色沉淀,则证明分解产物中有;G中发生反应的离子方程式为 .
(3)丙组将一定量的硫酸亚铁铵在500℃时隔绝空气加热一段时间后检验其固体产物,请设计实验证明:此固体产物不含二价铁: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知金属活动相差越大,形成原电池时越容易放电.请根据如图装置,回答下列问题: 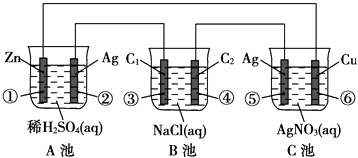
(1)各装置名称是:A池 , B池 .
(2)写出电极上发生的反应:① , ③ , ⑤ .
(3)当电路上有2mol电子流过时,①极上质量变化g,⑥极上质量变化g.
(4)反应进行一段时间后,A,B,C三池中电解质溶液浓度不变的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述中正确的是
4NO(g)+6H2O(g),下列叙述中正确的是
A.达到化学平衡状态时,4v正(O2)= 5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到化学平衡状态
C.达到化学平衡状态后,若增大容器容积,则正反应速率减小,逆反应速率增大
D.化学反应速率的关系为2v正(NH3)= 3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各 种性能的不锈钢,CrO3大量地用于电镀工业中. 
(1)在如图装置中,观察到图 1 装置铜电极上产生大量的无色气泡,而图 2 装置中铜电 极上无气体产生,铬电极上产生大量有色气体.
图 2 装置中铬电极的电极反应式
(2)最近赣州酒驾检查特别严,利用 CrO3 具有强氧化性,有机物(如酒精)遇到 CrO3 时,猛烈反应,CrO3 被还原成绿色的硫酸铬[Cr2(SO4)3],另该过程中乙醇被氧化成乙酸,从而增强导电性,根据电流大小可自动换算出酒精含量.写出该反应的化学方程式为 .
(3)虽然铬加到铁中可将铁做成不锈钢可减少金属腐蚀,但 生产成本高,生活中很多情况下还是直接使用钢铁,但易腐蚀,利用右图装置 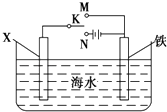 ,可以模拟铁的电化学防护.若 X 为碳棒,为减缓铁的腐蚀,开关 K 应置于处.若 X 为锌,开关K 置于处.
,可以模拟铁的电化学防护.若 X 为碳棒,为减缓铁的腐蚀,开关 K 应置于处.若 X 为锌,开关K 置于处.
(4)CrO3 和 K2Cr2O7 均易溶于水,这是工业上造成铬污染的主要原因.净化处理方法之一是将含+6 价 Cr 的废水放入电解槽内,用铁作阳极,加入适量的 NaCl 进行电解:阳极区生成的 Fe2+和 Cr2O72﹣发生反应,生成的 Fe3+和 Cr3+在阴极 区与OH﹣结合生成 Fe(OH)3和 Cr(OH)3 沉淀除去,已知某条件下的KspFe(OH)3=3.0×10﹣31 , KspCr(OH)3=6.0×10﹣38 . 已知电解后的溶液中 c(Fe3+)为 2.0×10﹣6 molL1 , 则溶液中 c(Cr3+)=molL﹣1 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com