
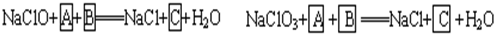
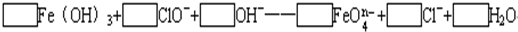
| n-4 |
| n-4 |
| 214×5.42×1022 |
| 3.21×2×6.02×1023 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
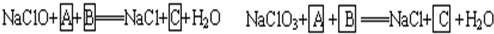
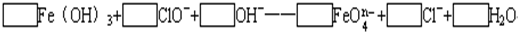
n- 4 |
n- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:
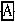 +
+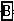 =NaCl+
=NaCl+ +H2O
+H2O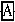 +
+ =NaCl+
=NaCl+ +H2O
+H2O Fe(OH)3+
Fe(OH)3+ ClO-+
ClO-+ OH-→
OH-→ Fe
Fe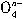 +
+ Cl- +
Cl- + H2O。
H2O。 中铁的化合价为_____________________。
中铁的化合价为_____________________。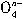 能与下列哪些物质反应(只填序号)______________。
能与下列哪些物质反应(只填序号)______________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com