
【题目】如图所示的装置中,A是氯气发生仪器,C、D 为气体净化装置(C中装有饱和食盐水,D中装有浓硫酸),E是硬质玻璃管装有细铁丝网,F为干燥的空广口瓶,烧杯G 中装有氢氧化钠溶液. 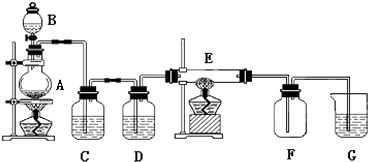
请回答下列问题:
(1)仪器A的名称是;
(2)实验室制氯气的化学方程式:MnO2+4HCl(浓);
(3)C装置的作用是;D装置的作用是;
(4)E中发生化学反应的方程式为:;
(5)烧杯G中发生反应的化学方程式为: .
【答案】
(1)圆底烧瓶
(2)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(3)除去氯气中混有的氯化氢;干燥氯气
(4)2Fe+3Cl2![]() 2FeCl3
2FeCl3
(5)Cl2+2NaOH=NaCl+NaClO+H2O
【解析】解:在加热条件下,二氧化锰和浓盐酸反应生成氯气、氯化锰和水;浓盐酸具有挥发性,导致制取的氯气中含有HCl,HCl极易溶于水,饱和食盐水中含有氯离子抑制氯气溶解,所以用饱和食盐水吸收氯化氢;D中含有浓硫酸,浓硫酸具有吸水性,能作干燥剂;在加热条件下,铁丝和氯气发生氧化还原反应生成氯化铁;氯气密度大于空气且常温下和空气不反应,可以采用向上排空气法收集氯气;氯气有毒不能直接排空,可以用碱性物质吸收氯气,(1)仪器A的名称是圆底烧瓶,所以答案是:圆底烧瓶;(2)加热条件下,二氧化锰和浓盐酸反应生成氯气、氯化锰和水,反应方程式为:MnO2+4 HCl(浓) ![]() MnCl2+Cl2↑+2 H2O,所以答案是:
MnCl2+Cl2↑+2 H2O,所以答案是: ![]() MnCl2+Cl2↑+2H2O;(3)浓盐酸具有挥发性,导致制取的氯气中含有HCl,HCl极易溶于水,饱和食盐水中含有氯离子抑制氯气溶解,所以用饱和食盐水吸收氯化氢;浓硫酸具有吸水性而干燥氯气,所以答案是:除去氯气中混有的氯化氢;干燥氯气;(4)在加热条件下,铁丝和氯气发生氧化还原反应生成氯化铁,反应方程式为2Fe+3Cl2
MnCl2+Cl2↑+2H2O;(3)浓盐酸具有挥发性,导致制取的氯气中含有HCl,HCl极易溶于水,饱和食盐水中含有氯离子抑制氯气溶解,所以用饱和食盐水吸收氯化氢;浓硫酸具有吸水性而干燥氯气,所以答案是:除去氯气中混有的氯化氢;干燥氯气;(4)在加热条件下,铁丝和氯气发生氧化还原反应生成氯化铁,反应方程式为2Fe+3Cl2 ![]() 2FeCl3,
2FeCl3,
所以答案是:2Fe+3Cl2 ![]() 2FeCl3;(5)氯气有毒不能直接排空,氯气和碱性物质反应生成无毒物质,所以E装置的作用是吸收多余的氯气,反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O,所以答案是:Cl2+2NaOH=NaCl+NaClO+H2O.
2FeCl3;(5)氯气有毒不能直接排空,氯气和碱性物质反应生成无毒物质,所以E装置的作用是吸收多余的氯气,反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O,所以答案是:Cl2+2NaOH=NaCl+NaClO+H2O.
【考点精析】关于本题考查的氯气的化学性质和氯气的实验室制法,需要了解氯气的化学性质:与金属反应将金属氧化成高价态;非金属反应;与水反应;与碱反应;与还原性物质反应;实验室制法:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O才能得出正确答案.


科目:高中化学 来源: 题型:
【题目】2015年10月,屠哟哟获得诺贝尔生理学或医学奖,理由是她发现了青蒿素,这种药品可以有效降低疟疾患者的死亡率.她成为首获科学类诺贝尔奖的中国人.青蒿素两步可合成得到治疗疟疾的药物青蒿琥酯.下列有关说法正确的是( )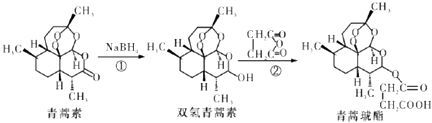
A.青蒿素分子式为C15H24O5
B.反应②原子利用率为100%
C.该过程中青蒿素生成双氢青蒿素属于氧化反应
D.1 mol青蒿琥酯与氢氧化钠溶液反应,最多消耗1 mol氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙基香草醛是食品添加剂的增香原料,它的香味浓郁,其结构简式为 ![]() ,下列对该物质叙述正确的是( )
,下列对该物质叙述正确的是( )
A.该物质可以进行消去反应
B.该物质可以进行水解反应
C.1 mol该物质最多可与3 mol H2反应
D.该物质可以和Br2进行取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》记载了民间酿酒的工艺“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次……价值数倍也”。以上用到的实验方法可应用于分离
A.酒精和水B.氯化钠和沙子的混合溶液
C.CCl4和硫酸钠溶液D.硝酸钾和氯化钠的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组用打磨过的铝片进行如下实验,下列分析不合理的是

A. ①中铝片发生了钝化
B. ②中产生的气泡可能是氮氧化合物
C. ③中沉淀溶解的离子方程式是Al(OH)3+ OH-=AlO2- + 2H2O
D. ②中加水稀释过程中,仅发生了氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在甲、乙两烧杯溶液中,分别含有大量Cu2+、K+、H+、Cl-、CO32-、OH-6种离子中的3 种,已知甲烧杯的溶液呈碱性,则乙烧杯溶液中大量存在的离子是( )
A. K+、H+、CO32- B. CO32-、OH-、Cl- C. K+、CO32-、Cl- D. Cu2+、H+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组以Ba(OH)2、水、H2SO4为实验对象探究离子反应发生的条件。
实验1:向烧杯中依次加入下列试剂,记录灯泡变化 | |
| ① Ba(OH)2粉末:灯泡不亮 ② 加入蒸馏水:灯泡变亮 ③ 逐滴滴加0.1 mol/L H2SO4,灯泡变化如下: |
(1)Ba(OH)2与H2SO4在溶液中能发生_________反应。
a. 复分解反应 b. 氧化还原反应 c. 置换反应
(2)加H2O后,灯泡变亮的原因是Ba(OH)2发生了___________。
(3)用离子方程式解释过程Ⅰ中灯泡变暗的原因_________。
(4)查阅有关物质溶解度数据如下表:
物质 | Ba(OH)2 | BaSO4 |
溶解度/g | 5.6 | 0.00025 |
比较溶液1、溶液2中c (SO42- )的大小: > ___________
(5)实验2:用Na2SO4溶液替代稀H2SO4,重复实验进行对照。
① Na2SO4溶液的浓度是_________。
② 加入Na2SO4溶液过程中灯泡不熄灭,原因是_________。
通过实验可知:离子反应发生的条件之一是生成沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上从铝土矿(主要成分是Al2O3,还含有SiO2、Fe2O3等杂质)中提取铝可选用如下工艺流程:

已知:SiO2不溶于水且不与盐酸反应。
请回答下列问题:
(1)图中涉及分离溶液与沉淀的实验方法是______(填操作名称)。
(2)步骤(Ⅱ)中加入的烧碱溶液应该是______(填“少量”或“过量”)。沉淀B的成分是______(填化学式,下同);溶液D中含铝元素的溶质的是______。
(3)①物质M在生产生活中有重要用途,写出沉淀F转化为物质M的化学方程式:______;
②溶液D中通入______CO2生成沉淀F的离子方程式为:______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置(电极均为惰性电极)可吸收SO2 , 并用阴极排出的溶液吸收NO2。下列关于该装置的四种说法,正确的组合是( )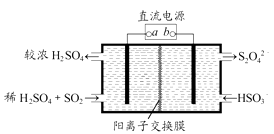
①.a为直流电源的负极
②.阴极的电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O
③.阳极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+
④.电解时,H+由阴极室通过阳离子交换膜到阳极室
A.①和②
B.①和③
C.②和③
D.③和④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com