
【题目】丙酮(CH3COCH3)在某溶剂里,在催化剂作用下发生反应:2CH3COCH3(aq) ![]() CH3COCH2COH(CH3)2(aq);取相同浓度的CH3COCH3,分别在40℃和60℃时,测得其转化率
CH3COCH2COH(CH3)2(aq);取相同浓度的CH3COCH3,分别在40℃和60℃时,测得其转化率![]() 随时间变化的关系曲线(
随时间变化的关系曲线(![]() )如图所示。
)如图所示。
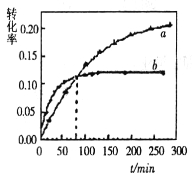
下列说法正确的是
A.b代表40℃时CH3COCH3的a—t曲线
B.升高温度可缩短该反应达平衡的时间并能提高平衡转化率
C.增大压强可缩短该反应达平衡的时间并能提高平衡转化率
D.上述反应的逆反应为吸热反应
【答案】D
【解析】
试题A.对于化学反应来说,升高温度,化学反应速率加快,达到平衡所需要的时间缩短,即温度高的首先达到平衡,所以b代表60℃时CH3COCH3的a—t曲线,错误;B.根据CH3COCH3的平衡转化率与温度的关系图像可知:升高温度,CH3COCH3的转化率降低,说明升高温度,平衡逆向移动。根据平衡移动原理:升高温度,平衡向吸热反应方向移动。逆反应方向是吸热反应,所以该反应的正反应是放热反应,因此升高温度,可缩短该反应达平衡的时间,但是不能提高平衡转化,错误;C.由于该反应没有气体物质参加,若增大压强,物质的浓度不变,反应速率不变,平衡不会发生移动,因此物质的平衡转化率不变,错误;D.升高温度,物质的平衡转化率降低,说明升高温度,平衡逆向移动,所以逆反应方向是吸热反应,,正确。


科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C的位置如图所示,已知B、C两元素所在族序数之和是A元素所在族序数的二倍,B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次
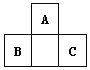
A. Be、Na、AlB. B、Mg、SiC. O、P、ClD. C、Al、P
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含![]() 废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的
废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的![]() 和
和![]() 可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室
可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室![]() 下列叙述正确的是
下列叙述正确的是![]()
![]()
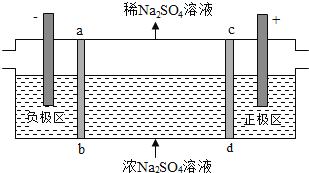
A. 通电后中间隔室的![]() 离子向正极迁移,正极区溶液pH增大
离子向正极迁移,正极区溶液pH增大
B. 该法在处理含![]() 废水时可以得到NaOH和
废水时可以得到NaOH和![]() 产品
产品
C. 负极反应为![]() ,负极区溶液pH降低
,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有![]() 的
的![]() 生成
生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍配合物在传感器、磁记录材料、储氢材料、电极催化剂和化学键研究等方面有着广泛的应用。以纯镍片为原料制备一种镍配合物[Ni(NH3)xCly]Clz·nH2O的主要流程如下:
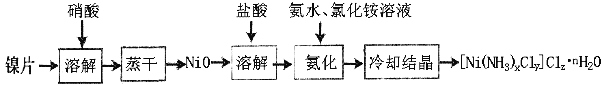
(1)工业上镍氢电池总反应式为:LaNi5H6 + NiOOH ![]() LaNi5 + Ni(OH)2,其中KOH作电解质溶液,负极电极反应式为:_______________________
LaNi5 + Ni(OH)2,其中KOH作电解质溶液,负极电极反应式为:_______________________
(2)常温下,镍投入60%的浓硝酸无明显现象,流程中需控制反应温度50-60oC,控温原因可能是_______,写出离子反应方程式:____________________________。
(3)冷却结晶后洗涤、过滤、干燥得到[Ni(NH3)xCly]Clz·nH2O,其中洗涤的正确操作是___________________________________________________________________。
(4)氨化过程中应控制溶液pH范围8~9,其原因是_____________________________。上述流程中,有关说法正确的是___________
A.氨化操作为在过量氨水和氯化铵缓冲溶液中,缓慢滴入酸化的NiCl2溶液,并不断搅拌
B.此缓冲溶液中微粒浓度大小顺序为:c(Cl—)> c(NH3·H2O) >c(NH4+) > c(OH—)> c(H+)
C.冷却结晶后的母液加适量氨水调节pH后可以循环利用
D.可以用热的浓硫酸和浓硝酸混合溶液代替浓硝酸溶解镍片
(5)为测定化合物[Ni(NH3)xCly]Clz·nH2O的组成,进行如下实验:
实验一:称取样品0.6460 g,加入过量的浓NaOH溶液,煮沸,冷却,蒸出的氨用40.00 mL 0.5000 mol·L-1的盐酸完全吸收,并用蒸馏水定容至100 mL,得溶液B。取B溶液20.00 mL,加入指示剂少量,用0.1000 mol·L-1NaOH滴定,消耗NaOH溶液20.00 mL。
实验二:另取该样品0.6460 g,溶于水,以0.1000 mol·L-1AgNO3溶液滴定至恰好反应完全,消耗AgNO3溶液20.00 mL。相应反应化学方程式为: [Ni(NH3)xCly]Clz+zAgNO3=[Ni (NH3)xCly] (NO3)z+zAgCl↓ 测得该镍配合物的化学式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬![]() 在溶液中主要以
在溶液中主要以![]() 蓝紫色
蓝紫色![]() 、
、![]() 绿色
绿色![]() 、
、![]() 橙红色
橙红色![]() 、
、![]() 黄色
黄色![]() 等形式存在,
等形式存在,![]() 为难溶于水的灰蓝色固体,回答下列问题:
为难溶于水的灰蓝色固体,回答下列问题:
(1)![]() 与
与![]() 的化学性质相似,在
的化学性质相似,在![]() 溶液中逐滴加入NaOH溶液直至过量,可察到的现象是 ______________________________________________ .
溶液中逐滴加入NaOH溶液直至过量,可察到的现象是 ______________________________________________ .
(2)![]() 和
和![]() 在溶液中可相互转化
在溶液中可相互转化![]() 室温下,初始浓度为
室温下,初始浓度为![]() 的
的![]() 溶液中
溶液中![]() 随
随![]() 的变化如图所示.
的变化如图所示.

![]() 用离子方程式表示
用离子方程式表示![]() 溶液中的转化反应______________________________ .
溶液中的转化反应______________________________ .
![]() 由图可知,溶液酸性增大,
由图可知,溶液酸性增大,![]() 的平衡转化率__________________
的平衡转化率__________________ ![]() 填“增大“减 小”或“不变”
填“增大“减 小”或“不变”![]() 根据A点数据,计算出该转化反应的平衡常数为 _______________ .
根据A点数据,计算出该转化反应的平衡常数为 _______________ .
![]() 升高温度,溶液中
升高温度,溶液中![]() 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的![]() ______
______ ![]() 填“大于”“小于”或“等于”
填“大于”“小于”或“等于”![]() .
.
(3)在化学分析中采用![]() 为指示剂,以
为指示剂,以![]() 标准溶液滴定溶液中的
标准溶液滴定溶液中的![]() ,利用
,利用![]() 与
与![]() 生成砖红色沉淀,指示到达滴定终点
生成砖红色沉淀,指示到达滴定终点![]() 当溶液中
当溶液中![]() 恰好完全沉淀
恰好完全沉淀![]() 浓度等于
浓度等于![]() 时,溶液中
时,溶液中![]() 为 ______
为 ______ ![]() ,此时溶液中
,此时溶液中![]() 等于 ______
等于 ______ ![]() 已知
已知![]() 、AgCl的
、AgCl的![]() 分别为
分别为![]() 和
和![]()
(4)![]() 价铬的化合物毒性较大,常用
价铬的化合物毒性较大,常用![]() 将废液中的
将废液中的![]() 还原成
还原成![]() ,反应的离子方程式为 _________________________________________________ .
,反应的离子方程式为 _________________________________________________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1985年,Rousssin研究发现了第一个金属原子簇类配位化合物,其结构如图1,金属原子簇类化合物与金属原子表面性质相似,具有良好的催化活性等功能。请回答下列问题:
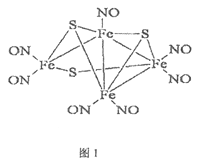
(1)Fe3+的基态核外价电子排布式为___________。
(2)上述化合物中含有三种非金属元素,试比较三种元素原子第一电离能由大到小顺序为_________;硫可以形成SOCl2化合物,则该化合物的空间构型为__________。
(3)除了氮的氧化物之外,氮还可以形成NO2+。请写出氮原子杂化方式____________。
(4)上述原子簇类配合物,中心原子铁的配位原子是___________。
(5)配合物Fe(CO)5的熔点-20℃,沸点103℃。可用于制备纯铁。Fe(CO)5的结构如下图所示。下列关于Fe(CO)5说法正确的是_________。
A. Fe(CO)5是非极性分子,CO是极性分子
B. Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C. 1mol Fe(CO)5含有10 mol配位键
D. Fe(CO)5 = Fe+5 CO反应中没有新化学键生成
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工厂排放的SO2烟气对环境造成污染,某企业用下图流程综合处理,下列有关说法正确的是

A. 二氧化硫吸收塔中发生的反应为SO2+SO32-+H2O=2HSO3-
B. 氨气吸收塔中发生的反应为HSO3-+OH-=H2O+SO32-
C. 上述流程利用的是氧化还原反应原理
D. 上述流程可循环利用的物质有2种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com