
| 步骤编号 | 实验操作 | 预期现象和结论 |
| 1. | 取少量溶液于试管中,滴入 | |
| 2. | 往装有沉淀的试管中加入 |
| HCO | - 3 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、铅蓄电池使用一段时间后要添加硫酸 |
| B、电池充电时,阴极反应为:Pb-2e-+SO42-═PbSO4 |
| C、电池充电时,电池正极应和电源的正极相连接 |
| D、电池放电时,电池正极周围溶液pH不断增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
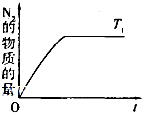 导致空气污染的主要原因来自于化石燃料燃烧、硫酸工业和汽车尾气的排放;致使大量二氧化硫和氮氧化物排入大气中.利用化学反应原理研究治理环境污染的方法是当前环保工作的重要研究内容之一.
导致空气污染的主要原因来自于化石燃料燃烧、硫酸工业和汽车尾气的排放;致使大量二氧化硫和氮氧化物排入大气中.利用化学反应原理研究治理环境污染的方法是当前环保工作的重要研究内容之一.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
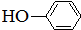 合成
合成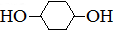 .(部分试剂和反应条件已略去)
.(部分试剂和反应条件已略去)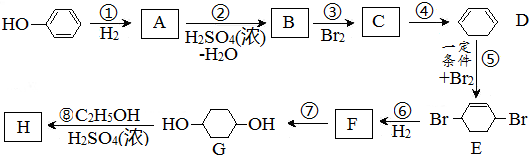
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、白铁(镀锌)的表面一量破损,铁腐蚀加快 |
| B、原电池中电子向负极流动 |
| C、马口铁(镀锡)的表面一旦破损,铁腐蚀加快 |
| D、用铝质铆钉接铁板,铁易被腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com