
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,它们能组成一种化合物,其结构如图所示。下列说法正确的是( )
![]()
A.原子半径:![]()
B.W与Z形成的化合物![]() 中只含离子键
中只含离子键
C.最高价氧化物对应水化物的酸性:![]()
D.W的单质难溶于W与X形成的化合物![]()
【答案】C
【解析】
根据题干信息可知,X、Y、Z、W为原子序数依次增大的短周期主族元素,它们能组成一种化合物![]() ,得出Z为+1价,X形成四个共用电子对,Y形成三个共用电子对,W形成一个共用电子对且又得到一个电子,则依次Z为Na,X为C,Y为N,W为S,据此分析解答。
,得出Z为+1价,X形成四个共用电子对,Y形成三个共用电子对,W形成一个共用电子对且又得到一个电子,则依次Z为Na,X为C,Y为N,W为S,据此分析解答。
A.同一周期,从左到右,原子半径减小,电子层数越多,原子半径越大,因此原子半径:Na > S > C > N,A选项错误;
B.W与Z形成的化合物Na2S2中含离子键和非极性共价键,B选项错误;
C.非金属性:N大于C,所以最高价氧化物对应水化物的酸性:HNO3 > HCO3,C选项正确;
D.S的单质易溶于CS2,D选项错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】有一处于平衡状态的反应X(g) +3Y(g)![]() 2Z(g) (正反应是放热反应) 。为了使平衡向生成Z的方向移动, 应选择的条件是
2Z(g) (正反应是放热反应) 。为了使平衡向生成Z的方向移动, 应选择的条件是
①升高温度 ②降低温度 ③增大压强 ④降低压强 ⑤加入正催化剂 ⑥分离出Z
A. ①③⑤ B. ②③⑤ C. ②③⑥ D. ②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Zn3(PO4)2·2H2O(溶于酸,难溶于水)是一种无毒害作用的防锈颜料,利用锌浮渣(主要含Zn、ZnO、ZnCl2,还含少量的铁、锰、铜、铅及砷的化合物等)制取Zn3(PO4)2·2H2O的工艺流程如图:
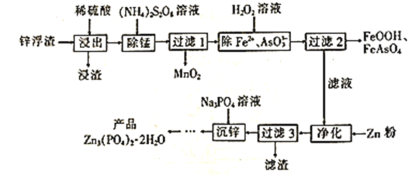
回答下列问题:
(1)“浸出”时,下列措施能提高锌的浸取率的是__(填字母)。
A.用浓硫酸代替稀硫酸 B.适当升高浸取液的温度
C.将“浸渣”再次浸取 D.缩短“浸出”时间
(2)“除锰”时,Mn2+发生反应的离子方程式为__(S2O![]() 被还原为SO
被还原为SO![]() )。
)。
(3)流程中除铁、砷时,当生成8.9gFeOOH和7.8gFeAsO4时,消耗H2O2__mol。
(4)“净化”时加锌粉的目的是__。
(5)“沉锌”时发生反应的化学方程式为__。
(6)“沉锌”至得到“产品”还需要经过的操作是__、洗涤、__。证明产品已洗涤干净的实验方法是__。
(7)Meyer等认为磷酸锌防腐机理是在钢铁表面形成组成近似为Zn2Fe(PO4)2·4H2O的覆盖膜,则在形成该覆盖膜的过程中,负极的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101 kPa时,1 g甲醇(CH3OH)完全燃烧生成CO2和液态H2O,同时放出22.68 kJ热量。下列表示该反应的热化学方程式中正确的是( )
A.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-725.8 kJ/mol
O2(g)=CO2(g)+2H2O(l) ΔH=-725.8 kJ/mol
B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=+1 451.6 kJ/mol
C.2CH3OH+3O2=2CO2+4H2O(l) ΔH=-22.68 kJ/mol
D.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(g) ΔH=-725.8 kJ/mol
O2(g)=CO2(g)+2H2O(g) ΔH=-725.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬及其化合物在材料、颜料及超导等方面用途非常广泛。回答下列问题:
(1)基态Cr原子的价电子排布式为__;Cr成为阳离子时首先失去__轨道的电子。
(2)铬与钾均位于第四周期,铬的熔点和沸点均比钾的高,这是因为__。
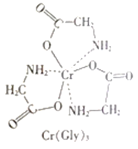
(3)甘氨酸铬(结构如图)是一种配合物,其配位原子是__。
(4)反应:6KSCN+13K2Cr2O7+55H2SO4=13Cr2(SO4)3+6SO2↑+6CO2↑+16K2SO4+55H2O
①KSCN的四种组成元素中第一电离能最大的是__(填元素符号);KSCN中阴离子的空间构型为___形,中心原子的杂化方式是__。
②分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() ),则NO2的大
),则NO2的大![]() 键可表示为__。
键可表示为__。
(5)立方CrO2晶体的结构如图所示,晶胞参数为apm。
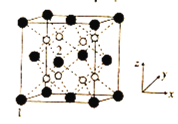
①设NA为阿伏加德罗常数的值,则CrO2的密度为__(列出计算式)g·cm-3。
②1、2号原子的坐标依次为(0,0,0)、(![]() ,0,
,0,![]() ),则原子坐标为(
),则原子坐标为(![]() ,
,![]() ,
,![]() )和(
)和(![]() ,
,![]() ,
,![]() )间的距离为__pm。
)间的距离为__pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是石蜡油在炽热碎瓷片的作用下产生乙烯并检验乙烯性质的实验,请回答下列问题:

(1)A中碎瓷片的作用是________。
(2)B装置中反应的化学方程式为__________。
(3)C装置中可观察到的现象是_________。
(4)查阅资料.乙烯与酸性高锰酸钾溶液反应产生二氧化碳,根据本实验中装置_____(填装置字母)中的实验现象可判断该资料是否直实。
(5)通过上述实验探究,检验甲烷和乙烯的方法是_______(填字母,下同),除去甲烷中乙烯的方法是___。
A 气体通入水中 B 气体通过盛溴水的洗气瓶
C 气体通过盛酸性高锰酸钾溶液的洗气瓶 D 气体通过氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的定容密闭容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g);经2 s后测得C的物质的量浓度为0.6 mol·L-1,现有下列几种说法:
2C(g);经2 s后测得C的物质的量浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的这段时间的平均速率为0.3 mol·L-1·s-1
②用物质B表示的这段时间的平均速率为0.6 mol·L-1·s-1
③2 s时物质A的转化率为30%
④2 s时物质B的物质的量浓度为0.3 mol·L-1
其中正确的是
A. ①③ B. ②④ C. ①② D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界上较早冶炼锌的国家。在现代工业中,锌更是在电池制造、合金生产等领域有着广泛的用途。
已知:锌的熔点为419.6℃,沸点907℃。
I.图是古代以炉甘石(ZnCO3)为原料炼锌的示意图。
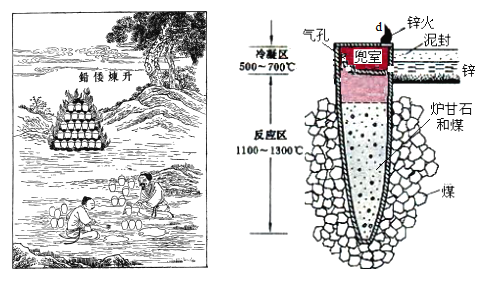
(1)泥罐内的主要反应为:
i.ZnCO3(s) = ZnO(s) + CO2(g) H1
ii.CO2(g) + C(s) = 2CO(g) H 2
……
总反应:ZnCO3(s) + 2C(s) = Zn(g) + 3CO(g) H3
利用H1和H 2计算时H3,还需要利用_________反应的H。
(2)泥罐中,金属锌的状态变化是_____;d口出去的物质主要是_______。
Ⅱ.现代冶炼锌主要采取湿法工艺。以闪锌矿(主要成分为ZnS,还含铁等元素)、软锰矿(主要成分为MnO2,还含铁等元素)为原料联合生产锌和高纯度二氧化锰的一种工艺的主要流程如下:
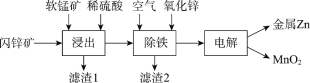
(3)浸出:加入FeSO4能促进ZnS的溶解,提高锌的浸出率,同时生成硫单质。Fe2+的作用类似催化剂,“催化”过程可表示为:
ⅰ:MnO2+2Fe2++4H+ =Mn2++2Fe3++2H2O
ⅱ:……
① 写出ⅱ的离子方程式:_________。
② 下列实验方案可证实上述“催化”过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量MnO2,溶液变红。
b.________。
(4)除铁:已知①进入除铁工艺的溶液的pH约为3;②控制溶液pH为2.5~3.5,使铁主要以FeOOH沉淀的形式除去。结合离子方程式说明,通入空气需同时补充适量ZnO的理由是_________。
(5)电解:用惰性电极电解时,阳极的电极反应是______。
(6)电解后的溶液中可循环利用的物质是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知CH3OH(l)的燃烧热ΔH=-238.6 kJ/mol,
CH3OH(l)+3/2O2(g)===CO2(g)+2H2O(g)ΔH=-a kJ/mol,则 a___238.6(填“>”、“<”或“=”)。
(2)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ 热量,写出该反应的热化学方程式:_________________________________
(3)反应mA(g)+nB(g)![]() pC(g) +qD(g)过程中的能量变化如图所示,回答下列问题。
pC(g) +qD(g)过程中的能量变化如图所示,回答下列问题。
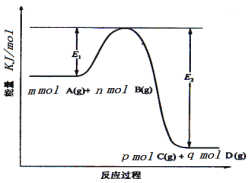
该反应△H =____kJ/mol(用含E1、E2式子表示); 在反应体系中加入催化剂,E1___,E2___,(填增大、减小、不变)。
(4)已知:
CO (g) +H2O (g)![]() H2 (g) +CO2 (g)平衡常数K
H2 (g) +CO2 (g)平衡常数K
C(s) +CO2 (g)![]() 2CO(g)平衡常数K1
2CO(g)平衡常数K1
C (s) +H2O (g)![]() CO(g) +H2 (g)平衡常数K2
CO(g) +H2 (g)平衡常数K2
则K、K1 、K2之间的关系是 ___________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com