
【题目】(1)已知CH3OH(l)的燃烧热ΔH=-238.6 kJ/mol,
CH3OH(l)+3/2O2(g)===CO2(g)+2H2O(g)ΔH=-a kJ/mol,则 a___238.6(填“>”、“<”或“=”)。
(2)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ 热量,写出该反应的热化学方程式:_________________________________
(3)反应mA(g)+nB(g)![]() pC(g) +qD(g)过程中的能量变化如图所示,回答下列问题。
pC(g) +qD(g)过程中的能量变化如图所示,回答下列问题。
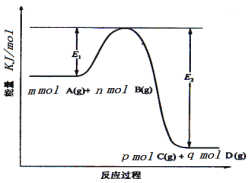
该反应△H =____kJ/mol(用含E1、E2式子表示); 在反应体系中加入催化剂,E1___,E2___,(填增大、减小、不变)。
(4)已知:
CO (g) +H2O (g)![]() H2 (g) +CO2 (g)平衡常数K
H2 (g) +CO2 (g)平衡常数K
C(s) +CO2 (g)![]() 2CO(g)平衡常数K1
2CO(g)平衡常数K1
C (s) +H2O (g)![]() CO(g) +H2 (g)平衡常数K2
CO(g) +H2 (g)平衡常数K2
则K、K1 、K2之间的关系是 ___________________________________
【答案】< 2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g) ΔH=-290 kJ/mol △H=-(E2-E1)kJ/mol 减小 减小 K=![]()
【解析】
(1)1mol甲醇完全燃烧生成CO2(g)和H2O(l)时, 放出的热量比生成CO2(g)和H2O(g)时,放出的热量多;
(2)有1 mol Cl2参与反应时释放出145 kJ 热量,2mol Cl2参与反应时释放出290 kJ 热量,据此写出反应的热化学方程式;
(3)H=反应物的总键能-生成物的总键能,所以H=E1-E2;加入催化剂改变了反应的途径,降低了反应所需的活化能;
(4)分别写出平衡常数K1、K2、K的表达式,据此可找出K与K2、K1之间的关系。
(1)燃烧热是1mol物质完全燃烧生成稳定的氧化物时放出的热量,1mol甲醇完全燃烧生成CO2(g)和H2O(l)时, 放出的热量为238.6 kJ,而当1mol甲醇完全燃烧生成CO2(g)和H2O(g)时,放出的热量小于238.6 kJ,故a<238.6;
故答案是:<;
(2)有1 mol Cl2参与反应时释放出145 kJ 热量,2mol Cl2参与反应时释放出290 kJ 热量,反应的热化学方程式:2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g) ΔH=-290 kJ/mol;
故答案是:2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g) ΔH=-290 kJ/mol;
(3)由图像可知该反应是一个能量降低的反应,所以属于放热反应;H=反应物的总键能-生成物的总键能,所以H=(E1-E2)kJ/mol;加入催化剂改变了反应的途径,降低了反应所需的活化能,所以E1、E2的变化是减小;
故答案是:△H= -(E2-E1)kJ/mol; 减小;减小;
(4)C(s) +CO2 (g)![]() 2CO(g)反应的平衡常数K1=c2(CO)/c(CO2);C (s) +H2O (g)
2CO(g)反应的平衡常数K1=c2(CO)/c(CO2);C (s) +H2O (g)![]() CO(g) +H2 (g)反应的平衡常数K2 = c(CO)c(H2)/c(H2O);CO (g) +H2O (g)
CO(g) +H2 (g)反应的平衡常数K2 = c(CO)c(H2)/c(H2O);CO (g) +H2O (g)![]() H2 (g) +CO2 (g)反应的平衡常数K= c(CO2)×c(H2)/ c(CO)×c(H2O),所以K=K2/K1;
H2 (g) +CO2 (g)反应的平衡常数K= c(CO2)×c(H2)/ c(CO)×c(H2O),所以K=K2/K1;
故答案是:K=K2/K1。


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,它们能组成一种化合物,其结构如图所示。下列说法正确的是( )
![]()
A.原子半径:![]()
B.W与Z形成的化合物![]() 中只含离子键
中只含离子键
C.最高价氧化物对应水化物的酸性:![]()
D.W的单质难溶于W与X形成的化合物![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作及现象进行的分析和推断中,不正确的是
操作 |
|
现象 | 一段时间后:①中,铁钉裸露在外的附近区域变红; ②中…… |
A.NaCl的琼脂水溶液为离子迁移的通路
B.①中变红是因为发生反应2H++2e-=H2↑,促进了水的电离
C.②中可观察到铁钉裸露在外的附近区域变蓝,铜丝附近区域变红
D.①和②中发生的氧化反应均可表示为M—2e-=M2+(M代表锌或铁)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关甲、乙、丙、丁四个图示的叙述正确的是( )
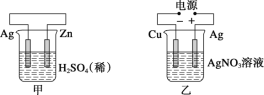
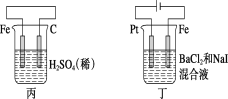
A.甲中负极反应式为2H++2e-=H2↑
B.乙中阳极反应式为Ag++e-=Ag
C.丙中H+向碳棒方向移动
D.丁中电解开始时阳极产生黄绿色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为N2H4+O2===N2+2H2O。下列说法正确的是
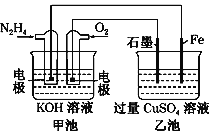
A. 乙池中Fe电极上发生氧化反应
B. 乙池中石墨电极上发生的反应可写为4OH--4e-===2H2O+O2↑
C. 甲池溶液pH增大,乙池溶液pH减小
D. 甲池中每消耗0.1 mol N2H4乙池电极上则会析出6.4 g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列十种物质:①H2O,②Cu,③NO,④Fe2O3,⑤稀硫酸,⑥氢氧化钡,⑦饱和FeCl3溶液,⑧氨水,⑨稀硝酸,⑩硫酸铝。根据上述提供的物质,回答下列问题:
(1)属于纯净物的是__________(填序号),属于电解质的是__________(填序号)。
(2)上述物质间发生的某反应的离子方程式为H++OH===H2O,则该反应的化学方程式为___________________________________________________。
(3)实验室制备少量Fe(OH)3胶体所用的物质有__________(填序号),反应的离子方程式为________________________________________________________。
(4)实验室配制245 mL 0.5 mol/L的硫酸铝溶液,从配制好的溶液中取出100 mL,其中含有的![]() 的数目为_______(设NA为阿伏加德罗常数的值)。
的数目为_______(设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X(g)+3Y(g)![]() 2W(g)+M(g) △H=-akJ·mol-1(a>0)一定温度下,在体积恒定的密闭容器中,加入1molX(g)与3molY(g),下列说法正确的是( )
2W(g)+M(g) △H=-akJ·mol-1(a>0)一定温度下,在体积恒定的密闭容器中,加入1molX(g)与3molY(g),下列说法正确的是( )
A.充分反应后,放出热量为akJ
B.当反应达到平衡状态时,X与W的物质的量浓度之比一定为1∶2
C.当体系的压强不再改变时,表明该反应已达平衡
D.若增大Y的浓度,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,有下列物质:①8gCH4、②6.02×1023个HCl分子、③2mol O2。按由小到大的顺序填写下列空白(填写序号):
(1)摩尔质量____________________。
(2)物质的量____________________。
(3)分子数目____________________。
(4)原子数目____________________。
(5)质量____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3经一系列反应可以得到HNO3和NH4NO3,如图所示。
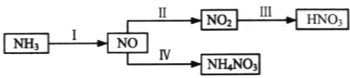
(1)Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是______。
(2)Ⅱ中,2NO(g)+O2(g)![]() 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。
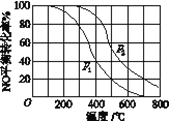
①比较p1、p2的大小关系:_______。
②随温度升高,该反应平衡常数变化的趋势是______。
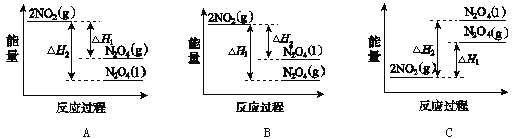
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。已知:2NO2(g)![]() N2O4(g) ΔH1 2NO2(g)
N2O4(g) ΔH1 2NO2(g)![]() N2O4(l) ΔH2,下列能量变化示意图中,正确的是____(选填字母)。
N2O4(l) ΔH2,下列能量变化示意图中,正确的是____(选填字母)。
(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图所示。
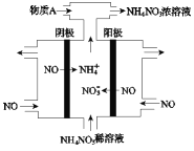
①写出阳极的电极反应式______
②为使电解产物全部转化为NH4NO3,需补充A。A是_____,说明理由:____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com