
【题目】NH3经一系列反应可以得到HNO3和NH4NO3,如图所示。
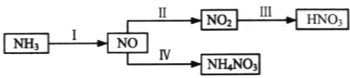
(1)Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是______。
(2)Ⅱ中,2NO(g)+O2(g)![]() 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。
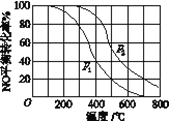
①比较p1、p2的大小关系:_______。
②随温度升高,该反应平衡常数变化的趋势是______。
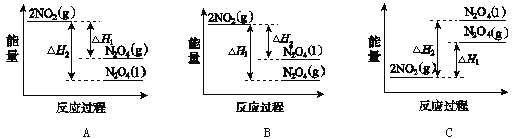
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。已知:2NO2(g)![]() N2O4(g) ΔH1 2NO2(g)
N2O4(g) ΔH1 2NO2(g)![]() N2O4(l) ΔH2,下列能量变化示意图中,正确的是____(选填字母)。
N2O4(l) ΔH2,下列能量变化示意图中,正确的是____(选填字母)。
(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图所示。
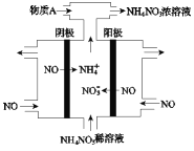
①写出阳极的电极反应式______
②为使电解产物全部转化为NH4NO3,需补充A。A是_____,说明理由:____。
【答案】4NH3+5O2![]() 4NO+6H2O p1<p2 减小 A NO-3e+2H2O=NO3-+4H+ NH3 根据反应:8NO+7H2O
4NO+6H2O p1<p2 减小 A NO-3e+2H2O=NO3-+4H+ NH3 根据反应:8NO+7H2O![]() 3NH4NO3+2HNO3,电解产生的HNO3多
3NH4NO3+2HNO3,电解产生的HNO3多
【解析】
(1)在催化剂、加热条件下,氨气被氧化生成NO和水,反应方程式为4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(2)①相同温度下,增大压强,平衡向正反应方向移动,则NO的转化率增大,根据图象知,相同温度下,p2的转化率大于p1,所以p2>p1;
②根据图象知,相同压强下,升高温度,NO转化率减小,说明正反应是放热反应,升高温度平衡向逆反应方向移动,则化学平衡常数减小;
(3)降低温度,将NO2(g)转化为N2O4(l)说明反应2NO2(g)N2O4(l)为放热反应,所以在图象中该反应的反应物的总能量比生成物的总能量高,同种物质气态变液态会放出热量,即液态时能量比气态时能量低,则N2O4(l)具有的能量比N2O4(g)具有的能量低,图象A符合。
答案选A;
(4)电解NO制备NH4NO3,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O![]() 3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3。
3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3。
①写出阳极的电极反应式为NO-3e-+2H2O=NO3-+4H+;
②根据反应:8NO+7H2O![]() 3NH4NO3+2HNO3,电解产生的HNO3多,为使电解产物全部转化为NH4NO3,需补充A。A是NH3。
3NH4NO3+2HNO3,电解产生的HNO3多,为使电解产物全部转化为NH4NO3,需补充A。A是NH3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(1)已知CH3OH(l)的燃烧热ΔH=-238.6 kJ/mol,
CH3OH(l)+3/2O2(g)===CO2(g)+2H2O(g)ΔH=-a kJ/mol,则 a___238.6(填“>”、“<”或“=”)。
(2)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ 热量,写出该反应的热化学方程式:_________________________________
(3)反应mA(g)+nB(g)![]() pC(g) +qD(g)过程中的能量变化如图所示,回答下列问题。
pC(g) +qD(g)过程中的能量变化如图所示,回答下列问题。
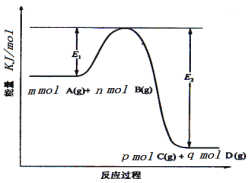
该反应△H =____kJ/mol(用含E1、E2式子表示); 在反应体系中加入催化剂,E1___,E2___,(填增大、减小、不变)。
(4)已知:
CO (g) +H2O (g)![]() H2 (g) +CO2 (g)平衡常数K
H2 (g) +CO2 (g)平衡常数K
C(s) +CO2 (g)![]() 2CO(g)平衡常数K1
2CO(g)平衡常数K1
C (s) +H2O (g)![]() CO(g) +H2 (g)平衡常数K2
CO(g) +H2 (g)平衡常数K2
则K、K1 、K2之间的关系是 ___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组为了探究CaCl2溶液和Na2SO4溶液反应有没有限度,设计了如下活动过程,请完成表中空格:(已知CaSO4在水中微溶,CaCO3在水中难溶)
实验步骤 | 向3-4 mL 1 mol/L的CaCl2溶液中滴入1mol/L的Na2SO4溶液至反应完全 |
实验现象 | _____________________ |
离子方程式 | _________________ |
小组讨论 交流 | 向上述反应后的清液中滴入适量1mol/L的Na2CO3 溶液会出现什么现象 |
对于实验现象提出的假设,说明理由 | 假设:①_____________________、②_______________________ 理由:①__________________、②_____________________。 |
实验证明你的假设 | 现象:____________________________________。 |
离子方程式 | _________________ |
解释 | _________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:H2NCOONH4(s)![]() 2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
温度 | 平衡浓度(mol·L-1) | |
c(NH3) | c(CO2) | |
T1 | 0.1 | |
T2 | 0.1 | |
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,转化的H2NCOONH4的物质的量Δn(T2)=2Δn(T1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.28g乙烯与丙烯组成的混合物中含碳碳双键的数目为NA
B.2mol冰醋酸与4mol乙醇一定条件下充分反应,生成乙酸乙酯个数为2NA
C.室温时,1.0LpH=13的Ba(OH)2溶液中含有OH-的数目为0.1NA
D.标准状况下11.2LCl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D在一定条件下的转化关系如图所示(反应条件已省略)。其中,A是一种气态烃,在标准状况下的密度是1.25 g·L-1,其产量是衡量一个国家石油化工发展水平的标志;C的分子式为C2H4O2;B和C在浓硫酸和加热的条件下发生反应,生成的有机物D有特殊的香味。
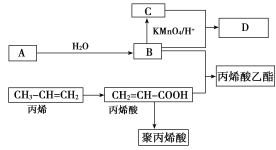
试回答下列问题:
(1)A的分子式为________,丙烯酸分子结构中所含的官能团名称是________,丙烯分子中最多有________个原子共平面。
(2)丙烯酸乙酯可能发生的反应类型有________。
①加成反应 ②取代反应 ③加聚反应 ④中和反应
A.①③ B.①②③
C.①③④ D.①②③④
(3)写出聚丙烯酸的结构简式________。
(4)写出丙烯酸与B反应的化学方程式_________________________________________________。
(5)下列有关说法正确的是________(填编号)。
A.D与丙烯酸乙酯互为同系物
B.B→C的转化是氧化反应
C.可以用酸性KMnO4溶液鉴别A和丙烯酸
D.蒸馏能分离B和C的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2 min末该反应达到平衡,测得生成0.8 mol D, 0.4 mol C。下列判断不正确的是
xC(g)+2D(g)。2 min末该反应达到平衡,测得生成0.8 mol D, 0.4 mol C。下列判断不正确的是
A. x =1
B. 2 min时,A的浓度为0.9mol·L-1
C. 2 min内A的反应速率为0.3 mol·L-1·min-1
D. B的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组同学探究NH3与Cl2的反应,装置如图所示。常温常压下,将氨气收集在薄膜保鲜袋(无弹性)中,氯气收集在反应管中,关闭K,按图连接好装置;将氨气压入反应管,充分反应后打开K。下列说法错误的是

A.反应开始后,保鲜袋逐渐被吸入反应管
B.反应过程中,反应管中产生白烟
C.打开K后,水会倒吸入反应管
D.上述反应原理可用于检验输送氯气的管道是否泄漏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸(CH3COOOH)是常用的消毒剂,易溶于水、易挥发、见光或受热易分解。制备原理为:H2O2+CH3COOH![]() CH3COOOH+H2O △H<0,制得的过氧乙酸(含少量H2O2)含量测定流程如下,下列说法不正确的是( )
CH3COOOH+H2O △H<0,制得的过氧乙酸(含少量H2O2)含量测定流程如下,下列说法不正确的是( )
![]()
A.应在密闭、低温、避光条件下保存过氧乙酸
B.在常压条件下采用蒸馏操作将过氧乙酸分离出来
C.溶液由无色变为浅红色且30s内不变色,说明H2O2已除尽
D.加过量硫酸亚铁溶液目的是还原CH3COOOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com