
| 实 验 内 容 | 实 验 方 法 | 实 验 现 象 |
| 验证氧化性 | ||
验证氧化性 |
| 0.85cV |
| 10.00ml×ρg/ml |
| 17cV |
| 200ρ |
| 17cV |
| 200ρ |
| 实 验 内 容 | 实 验 方 法 | 实 验 现 象 |
| 验证氧化性 | 取适量饱和硫化氢溶液于试管中,滴入 过氧化氢溶液. | 产生淡黄色沉淀或溶液变浑浊 |
验证氧化性 | 取适量碘化钾淀粉溶液于试管中,加入过氧化氢溶液 | 溶液变蓝色 |
| 实 验 内 容 | 实 验 方 法 | 实 验 现 象 |
| 验证氧化性 | 取适量饱和硫化氢溶液于试管中,滴入 过氧化氢溶液. | 产生淡黄色沉淀或溶液变浑浊 |
验证氧化性 | 取适量碘化钾淀粉溶液于试管中,加入过氧化氢溶液 | 溶液变蓝色 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
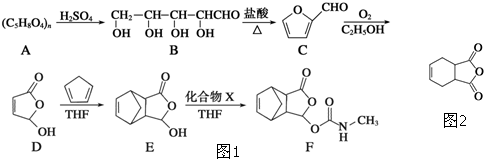
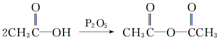 化合物G(结构如图2所示)是合成抗病毒药阿昔洛韦的中间体.请写出以OHCCH(Br)CH2CHO和1,3-丁二烯为原料制备G的合成路线流程图2(无机试剂任用).合成路线流程图示例如下:H2C=CH2
化合物G(结构如图2所示)是合成抗病毒药阿昔洛韦的中间体.请写出以OHCCH(Br)CH2CHO和1,3-丁二烯为原料制备G的合成路线流程图2(无机试剂任用).合成路线流程图示例如下:H2C=CH2| HBr |
| NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
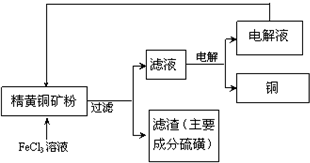 工业上以黄铜矿(主要成分CuFeS2)为原料制备金属铜,有如下两种工艺.
工业上以黄铜矿(主要成分CuFeS2)为原料制备金属铜,有如下两种工艺.查看答案和解析>>
科目:高中化学 来源: 题型:
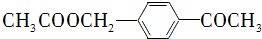 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C═CH2
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C═CH2| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| NaNO2 |
| ①O3 |
| ②Zn/H2O |
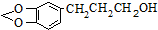 是一种合成药物的中间体,以CH2(COOH)2、CH2Cl2 及
是一种合成药物的中间体,以CH2(COOH)2、CH2Cl2 及 (无机试剂任用)为原料制备该化合物,请将合成该化合物路线流程图补充完整.
(无机试剂任用)为原料制备该化合物,请将合成该化合物路线流程图补充完整.| 反应试剂 |
| 反应条件 |
| 反应试剂 |
| 反应条件 |
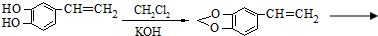
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去乙酸乙酯中混有的少量乙酸:加入饱和碳酸钠溶液,振荡、静置、分液 |
| B、除去乙醇中混有的少量水:加入适量的金属钠,充分反应后蒸馏 |
| C、除去溴苯中混有的少量溴:加入足量的氢氧化钠溶液,振荡、静置、分液 |
| D、除去96%的乙醇中的少量水制无水乙醇:加入生石灰,振荡、静置、蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数Kc | 9.94 | 9 | 1 |
| A | B | C | D | E | |
| n(CO2) | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 2 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com