
| A. | 酸式盐的水溶液一定显酸性 | |
| B. | 只要酸与碱的物质的量浓度和体积分别相等,它们反应后的溶液就呈中性 | |
| C. | 纯水呈中性是因为水中c(H+)和c(OH-)相等 | |
| D. | NaHCO3与Na2SO4溶液的混合溶液呈中性 |
分析 A.弱酸的酸式盐存在电离和水解,溶液酸碱性取决于电离程度和水解程度大小;
B.酸碱强弱不同,元数不同酸碱性不同;
C.中性溶液中氢离子的浓度等于氢氧根离子的浓度;
D.NaHCO3溶液显碱性.
解答 解:A.弱酸的酸式盐存在电离和水解,溶液酸碱性取决于电离程度和水解程度大小,如NaHSO3以电离为主呈酸性,NaHCO3溶液以水解为主呈碱性,故A错误;
B.酸碱强弱不同,元数不同酸碱性不同,如醋酸和氢氧化钠反应生成醋酸钠溶液显碱性,故B错误;
C.中性溶液中氢离子的浓度等于氢氧根离子的浓度,所以纯水呈中性是因为水中氢离子的物质的量浓度和氢氧根离子的物质的量浓度相等,故C正确;
D.NaHCO3溶液显碱性,Na2SO4溶液显中性,所以NaHCO3与Na2SO4溶液的混合溶液呈碱性,故D错误;
故选C.
点评 本题考查了盐类水解和弱酸的电离的分析判断,溶液酸碱性的理解应用,掌握基础是关键,题目较简单,注意酸式盐溶液的酸碱性的判断.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
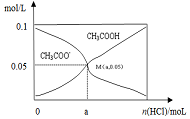 常温下向10mL 0.1mol•L-1CH3COONa溶液中,不断通入HCl后,CH3COO-与CH3COOH浓度的变化趋势如图所示(不考虑溶液体积变化),下列说法不正确的是( )
常温下向10mL 0.1mol•L-1CH3COONa溶液中,不断通入HCl后,CH3COO-与CH3COOH浓度的变化趋势如图所示(不考虑溶液体积变化),下列说法不正确的是( )| A. | M点溶液中水的电离程度比原溶液小 | |
| B. | 在M点时,c(H+)-c(OH-)=(100a-5.0×10-2) mol/L | |
| C. | 随着HCl的通入,$\frac{c(O{H}^{-})}{c(C{H}_{2}CO{O}^{-})}$值不断减小 | |
| D. | 当n(HCl)=1.0×10-3mol时,溶液中c(Na+)>c(Cl-)>c(CHCOO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 71 g Cl2所含原子数为2NA | |
| B. | 在常温常压下,1 mol氦气含有的原子数为2NA | |
| C. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离子数为0.05NA | |
| D. | 标准状况下,1 mol H2O和1 mol H2的体积都约为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成物质一定是化合物 | |
| B. | 构成物质一定是单质 | |
| C. | 构成物质可能只有一种元素 | |
| D. | 物质的组成元素一定是两种或两种以上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890kJ•mol-1 | |
| C. | CH4(g)+O2(g)═CO2(g)+H2O(l)△H=-890kJ•mol-1 | |
| D. | 2CH4(g)+4O2(g)═2CO2(g)+4H2O(g)△H=+890kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往氨水中滴加酚酞 | B. | NO气体暴露在空气中 | ||
| C. | Cl2通过湿润的有色布条 | D. | 往NaOH溶液中通入CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
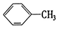 ②
②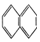 ③
③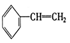 ④C2H4⑤CH2=CH-CH=CH2⑥C3H4⑦
④C2H4⑤CH2=CH-CH=CH2⑥C3H4⑦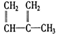 ⑧
⑧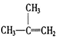
| A. | ④和⑥ | B. | ①、②和③ | C. | ⑤和⑦ | D. | ④、⑥和⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com