
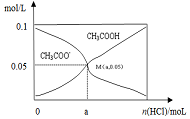
 常温下向10mL 0.1mol•L-1CH3COONa溶液中,不断通入HCl后,CH3COO-与CH3COOH浓度的变化趋势如图所示(不考虑溶液体积变化),下列说法不正确的是( )
常温下向10mL 0.1mol•L-1CH3COONa溶液中,不断通入HCl后,CH3COO-与CH3COOH浓度的变化趋势如图所示(不考虑溶液体积变化),下列说法不正确的是( )| A. | M点溶液中水的电离程度比原溶液小 | |
| B. | 在M点时,c(H+)-c(OH-)=(100a-5.0×10-2) mol/L | |
| C. | 随着HCl的通入,$\frac{c(O{H}^{-})}{c(C{H}_{2}CO{O}^{-})}$值不断减小 | |
| D. | 当n(HCl)=1.0×10-3mol时,溶液中c(Na+)>c(Cl-)>c(CHCOO-)>c(H+)>c(OH-) |
分析 A.CH3COO-水解促进水的电离,CH3COOH电离出氢离子抑制水的电离;
B.根据电荷守恒计算;
C.根据水解常数Kh=$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$结合CH3COOH浓度的变化分析;
D.当n(HCl)=1.0×10-3mol时,CH3COONa与HCl恰好反应生成NaCl和CH3COOH,溶液显酸性.
解答 解:A.CH3COO-水解促进水的电离,CH3COOH电离出氢离子抑制水的电离,原溶液为醋酸钠溶液,醋酸根离子水解促进水的电离,M点溶液显酸性,醋酸电离的氢离子抑制水的电离,所以M点溶液中水的电离程度比原溶液小,故A正确;
B.在M点时,溶液中存在电荷守恒为c(Na+)+c(H+)=c(Cl-)+c(CHCOO-)+c(OH-),则c(H+)-c(OH-)=c(Cl-)+c(CHCOO-)-c(Na+)=100a+0.05-0.1=(100a-5.0×10-2) mol/L,故B正确;
C.温度不变,水解常数Kh=$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$不变,随着HCl的加入,CH3COOH浓度逐渐增大,所以$\frac{c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$逐渐减小,故C正确;
D.当n(HCl)=1.0×10-3mol时,CH3COONa与HCl恰好反应生成等浓度的NaCl和CH3COOH,由于CH3COOH部分电离溶液显酸性,所以c(Na+)=c(Cl-)>c(H+)>c(CHCOO-)>c(OH-),故D错误.
故选D.
点评 本题考查弱电解质的电离以及盐的水解等方面的知识,注意把握溶液中的电荷守恒、影响水的电离平衡因素的分析判断,注意知识的归纳和梳理是解题的关键,题目难度中等.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 倭铅是指金属锌和铅的混合物 | B. | 煤炭中起作用的主要成分是C | ||
| C. | 我国历史上铅的使用早于锌 | D. | 该冶炼锌的方法属于热还原法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2)(3) | B. | (1)(3)(6) | C. | (1)(2)(5)(6) | D. | (1)(3)(6)(7) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 升高温度可使该反应的逆反应速率降低 | |
| B. | 反应达到平衡后,NO的反应速率保持恒定 | |
| C. | 使用高效催化剂只能提高正反应速率 | |
| D. | 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰镇的啤酒打开后泛起泡沫 | |
| B. | 由H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 | |
| C. | 工业制取金属钾Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 | |
| D. | 黄绿色的氯水光照后颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LSO3所含的分子数为NA | |
| B. | 49g硫酸中所含氧原子的数目为2NA | |
| C. | 1molNH4+所含质子数为10NA | |
| D. | 0.5L 0.2 mol•L-1硫酸钠溶液中含有的SO42-离子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
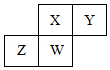 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )| A. | 最简单气态氢化物的热稳定性:Y>X>W>Z | |
| B. | 最高价氧化物对应的水化物的酸性:X>W>Z | |
| C. | 原子半径:W>Z>Y>X | |
| D. | 元素X、Z、W的最高正价分别与其主族序数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式盐的水溶液一定显酸性 | |
| B. | 只要酸与碱的物质的量浓度和体积分别相等,它们反应后的溶液就呈中性 | |
| C. | 纯水呈中性是因为水中c(H+)和c(OH-)相等 | |
| D. | NaHCO3与Na2SO4溶液的混合溶液呈中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com