
分析 NaHSO4是强酸酸式盐,为强电解质,在水溶液中电离方程式为NaHSO4=Na++H++SO42-,导致溶液中c(H+)>c(OH-),据此判断溶液酸碱性.
解答 解:NaHSO4是强酸酸式盐,为强电解质,在水溶液中电离方程式为NaHSO4=Na++H++SO42-,导致溶液中c(H+)>c(OH-),则该溶液呈酸性,答:NaHSO4溶液显酸性;NaHSO4在水溶液中完全电离生成氢离子导致溶液中c(H+)>c(OH-),则该溶液呈酸性.
点评 本题考查电解质的电离及溶液酸碱性判断,为高频考点,明确硫酸氢钠电离方式是解本题关键,注意:硫酸氢钠在水溶液中电离生成钠离子、氢离子和硫酸根离子,在熔融状态下电离生成钠离子和硫酸氢根离子,题目难度不大.


科目:高中化学 来源: 题型:解答题
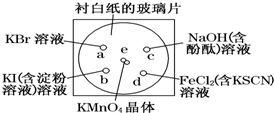 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeO | B. | Fe2O3 | C. | FeCl3 | D. | Fe3O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学平衡是动态平衡 | |
| B. | 各反应物的浓度等于各生成物的浓度 | |
| C. | 正逆反应速率为零 | |
| D. | 反应物和生成物的浓度不再改变,反应已停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 甲 | 乙 |
| ① | SO2 | 石灰水 |
| ② | CO2 | 石灰水 |
| ③ | SO2 | Ba(NO3)2 |
| ④ | NO2 | CaCl2 |
| A. | ②③④ | B. | ②③ | C. | ①③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素相对原子质量依次递增 | |
| B. | 元素的最高正化合价呈周期性变化 | |
| C. | 元素原子最外层电子排布呈周期性变化 | |
| D. | 元素金属性或非金属性呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
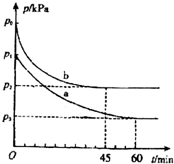 硫及其化合物对人类的生产和生活有着重要的作用.
硫及其化合物对人类的生产和生活有着重要的作用.| 实验编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
| N(SO2) | N(NO2) | N(NO) | ||
| 甲 | T1 | 0.80 | 0.20 | 0.18 |
| 乙 | T2 | 0.20 | 0.80 | 0.16 |
| 丙 | T3 | 0.20 | 0.30 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
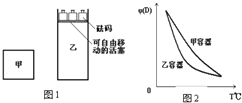 一定温度下,有可逆反应:2A(g)+2B(g)?C(g)+3D(g);△H<0.现将2molA和2mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图1).关于两容器中反应的说法正确的是( )
一定温度下,有可逆反应:2A(g)+2B(g)?C(g)+3D(g);△H<0.现将2molA和2mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图1).关于两容器中反应的说法正确的是( )| A. | 甲容器中的反应先达到化学平衡状态 | |
| B. | 两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成相同,混合气体的平均相对分子质量也相同 | |
| C. | 两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2所示 | |
| D. | 在甲容器中再充入2 mol A和2 mol B,平衡后甲中物质C的浓度和乙中物质C的浓度相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com