
| A、用加入铁粉的方法除去Cu(NO3)2溶液中混有的AgNO3 |
| B、用NaOH溶液除去CO2中混有的HCl气体 |
| C、向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液中的SO42- |
| D、用蒸馏的方法提纯含有少量可溶性杂质的水 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
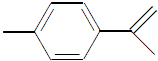 ,下列关于这种物质的说法中正确的是( )
,下列关于这种物质的说法中正确的是( )| A、分子式为C9H12 |
| B、易发生取代反应,难发生加成反应 |
| C、可使溴的四氯化碳溶液褪色 |
| D、该物质易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在K2SO4与BaCl2两溶液反应时,增大压强 |
| B、Fe与稀硫酸反应制取H2时,改用浓硫酸 |
| C、Na与水反应时增大水的用量 |
| D、Al在氧气中燃烧生成A12O3,将Al片改成Al粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、按化学家的观点来看:世界上没有真正的垃圾,只是放错了地方的资源 |
| B、尽管可充电电池的使用寿命相对较长,但这类电池仍须进行回收处理 |
| C、对医疗垃圾主要采取焚烧法进行处理,因病毒全部杀死,焚烧产物可任意排放 |
| D、商品过度包装及其一次性的大量使用,既增加了垃圾量又造成了资源的极大浪费 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在A溶剂中,甲的酸性大于乙;在B的溶剂中,甲的酸性可能小于乙 |
| B、比较HCl、H2SO4、HClO4、HNO3酸性的强弱,用水肯定不可以,用冰醋酸可能可以 |
| C、HNO3在HClO4中是酸,在H2SO4中可能是碱 |
| D、比较HCN与HAc酸性的强弱,用水肯定可以,用液氨肯定也可以 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=9 |
| B、c(OH-)≈10-5 mol?L-1 |
| C、pH≈7 |
| D、c(OH-)<10-7 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=l或pH=13 |
| B、阴离子肯定有I-,不能确定有无HCO3 |
| C、阴离子肯定没有Fe3+,不能确定有无Na+ |
| D、溶质有3种可能:①HI②HI和NaI③NaI和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L CCl4含有NA个分子 |
| B、常温常压下46g NO2和N2O4混合气体含有3NA个原子 |
| C、0.1mol AlCl3完全转化为氢氧化铝胶体,生成0.lNA个胶体粒子 |
| D、0.1mol Cl2与足量NaOH溶液反应,转移电子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com