
| m |
| n |
| c(A)c(OH-) |
| c(A-) |
| Kw |
| Ka |
| m |
| n |
| 0.1221g |
| 0.001mol |
| ||
| 0.15L |
| c(H+)?c(A-) |
| c(A) |
| c(A)c(OH-) |
| c(A-) |
| Kw |
| Ka |
| Kw |
| Ka |
|
|


科目:高中化学 来源: 题型:
| A、原子半径:W>Y>Z>M>X |
| B、化合物乙中一定只有共价键 |
| C、W元素是一种亲氧元素 |
| D、X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM,沸点X2Z>XM |
查看答案和解析>>
科目:高中化学 来源: 题型:

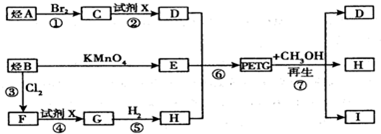 这种材料可采用如图所示的合成路线已知:(1)
这种材料可采用如图所示的合成路线已知:(1)
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
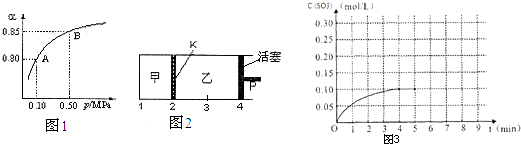
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增.已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的
A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增.已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
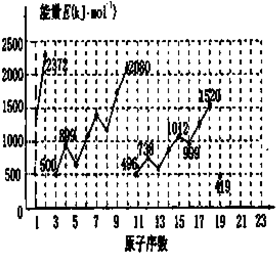 原子序数依次递增的A、B、C、D、E是周期表中前30号元素.已知A的最外层电子数是其内层电子数的2倍;A与C形成的常见化合物之一是主要的温室气体;D与A同主族,其单质在同周期元素所形成的单质中熔点最高;E原子M能层为全充满状态,且核外的未成对电子只有一个.请回答下列问题:
原子序数依次递增的A、B、C、D、E是周期表中前30号元素.已知A的最外层电子数是其内层电子数的2倍;A与C形成的常见化合物之一是主要的温室气体;D与A同主族,其单质在同周期元素所形成的单质中熔点最高;E原子M能层为全充满状态,且核外的未成对电子只有一个.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
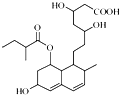 普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关系普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关系普伐他汀的性质描述正确的是( )| A、能与FeCl3溶液发生显色反应 |
| B、能使酸性KMnO4溶液褪色 |
| C、1mol该物质与足量钠发生反应生成4molH2 |
| D、1mol该物质最多可与1molNaOH反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com