
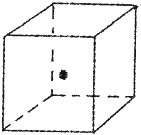
 A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增.已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的
A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增.已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
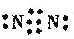 ,F为Cl元素,电子排布式为1s22s22p63s23p5,EMg元素,原子核外有3个电子层,最外层电子数为2,原子结构示意图为
,F为Cl元素,电子排布式为1s22s22p63s23p5,EMg元素,原子核外有3个电子层,最外层电子数为2,原子结构示意图为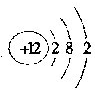 ,
,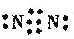 ;1s22s22p63s23p5;
;1s22s22p63s23p5; ;
;
| ||
| ||
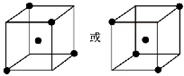 ,
, .
.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
| A、向豆浆中加入盐卤做豆腐 |
| B、长江三角洲、珠江三角洲的形成 |
| C、一束平行光线射入蛋白质溶液里,从侧面可以看到一束光亮的通路 |
| D、向石灰水中通入二氧化碳气体产生白色浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡向正反应方向移动了 |
| B、平衡向逆反应方向移动了 |
| C、物质A的质量分数增加了 |
| D、b<a |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、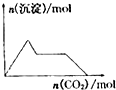 向含0.01mol KOH和0.01mol Ca(OH)2的混合溶液中缓慢通入CO2至过量 |
B、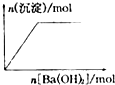 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量 |
C、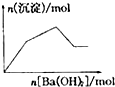 向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至过量 |
D、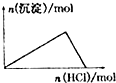 向NaAlO2溶液中逐滴加入盐酸至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 过量NH3 |
| Ⅰ |
| 过量CO2 |
| Ⅱ |
溶解度(g) 温度(℃) | NH4Cl | NH4HCO3 | NaHCO3 | NaCl | Na2CO3 | (NH4)2CO3 |
| 20 | 28.7 | 21.7 | 9.6 | 31.5 | 21.5 | 100 |
| 30 | 41.1 | 27.0 | 11.1 | 36.3 | 39.7 | >100 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HX可能是强酸 |
| B、NaX水溶液的碱性弱于NaY水溶液的碱性 |
| C、HX一定是弱酸 |
| D、反应过程中二者生成H2的速率相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com