
【题目】下列物质在一定条件下可以转化的是( )
A.CaCl2 ![]() CaCO3
CaCO3 ![]() CaO
CaO
B.Fe ![]() FeCl2
FeCl2 ![]() Fe(OH)2
Fe(OH)2
C.Al2O3 ![]() NaAlO2
NaAlO2 ![]() Al(OH)3
Al(OH)3
D.SiO2 ![]() H2SiO3
H2SiO3 ![]() Na2SiO3
Na2SiO3
科目:高中化学 来源: 题型:
【题目】对四种无色溶液进行离子检验,实验结果如下,其中明显错误的是
A. K+、Na+、Cl-、NO3- B. K+、NO3-、OH-、HCO3-
C. Na+、OH-、Cl-、NO3- D. MnO4-、K+、S2-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应X2(g)+Y2(g)![]() 2XY(g) ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )
2XY(g) ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )
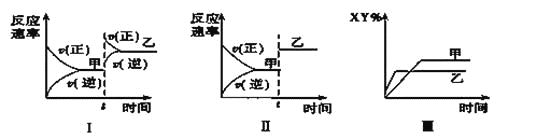
A. 图Ⅰ是增大压强的变化情况
B. 图Ⅱ是一定是加入催化剂的变化情况
C. 图Ⅲ是增大压强或升高温度的变化情况
D. 图Ⅲ一定是升高温度的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年8月12日,天津滨海新区爆炸事故确认有氰化钠(NaCN)、亚硝酸钠等,氰化钠毒性很强,遇水、酸会产生有毒易燃氰化氢(HCN)气体。氰化氢的沸点只有26 ℃,因此相当容易挥发进入空气,这就大大增加了中毒的风险。同时氰化钠遇到亚硝酸钠会发生爆炸。回答下列问题:
(1)写出氰化钠遇水产生氰化氢气体的离子方程式_________________________
(2)爆炸现场约700吨的氰化钠大约需要900吨的双氧水来处理。氰化钠与双氧水相遇后,会释放出氨气同时析出白色晶体,使得氰化钠的毒性大大降低,写出氰化钠与双氧水反应的化学方程式________________________________。
(3)爆炸残留在废水中的CN-可以用Cr2O![]() 处理,拟定下列流程进行废水处理,
处理,拟定下列流程进行废水处理,
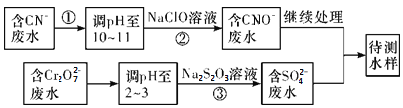
①上述处理废水流程中主要使用的方法是____________
a.混凝法 b.中和法 c.沉淀法 d.氧化还原法
②②中反应后无气体放出,该反应的离子方程式为_________________;
③步骤③中,每处理0.4 mol Cr2O![]() 时转移电子2.4 mol,该反应的离子方程式_________;
时转移电子2.4 mol,该反应的离子方程式_________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH2OH(CHOH)4CHO是葡萄糖的结构简式,它不可能发生的化学反应是( )
A.燃烧
B.银镜反应
C.水解反应
D.与新制备的Cu(OH)2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下: 低温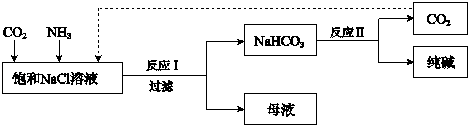
已知反应I为:NaCl+CO2+NH3+H2O ![]() NaHCO3↓+NH4Cl
NaHCO3↓+NH4Cl
(1)工业生产中,制备NH3的化学方程式是
(2)海水中含有大量的NaCl,以及少量的Ca2+、Mg2+、SO42﹣等离子. ①为得到纯净的饱和NaCl溶液,进行了如下操作.请补全操作步骤:
a.向浓缩后的海水中加入过量的氢氧化钠溶液后,过滤;
b.向滤液中 , 过滤;
c.向滤液中 , 过滤;
d.向滤液中加入足量的稀盐酸;
e.加热煮沸一段时间,得到饱和NaCl溶液.
②步骤c中反应的离子方程式是 .
(3)反应II的化学方程式是 .
(4)制得的纯碱中含有少量NaCl.取5.5g纯碱样品加入足量稀硫酸,得到标准状况下1120mL CO2 . 则样品中纯碱的质量分数是%(保留1位小数).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在国民经济中占有重要地位。
I.合成氨工业中,初始时氮气、氢气的体枳比为1:3时,每反应1mol N2,放出92.2kJ热量。如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,平衡混合物中氨的体积分数。
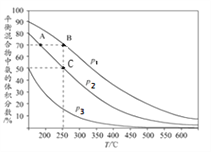
①由图可知:p1、p2、p3的大小关系为________,理由是_____________________________
②A、B点生成氨气的速率大小关系为_____________,C点,N2的转化率为_____。
③下列关于合成氨的说法正确是_________ (填序号)。
A.断开1个N≡N键的同时有6个N—H键形成,反应一定达到平衡状态
B.混合气体的平均相对分子质量不再改变状态,反应一定达到平衡状态
C.由于△H<0、△S>0,故合成氨反应一定能自发进行
D.增大n(N2):n(H2)的比值,有利用提离H2的转化率
II.最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。其电池反应为4NH3+3O2==2N2+6H2O,写出负极的电极反应式:__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:
C(s)+2NO(g)![]() CO2(g)+N2(g),平衡时c (NO)与温度T的关系如下图所示,则下列说法正确的是
CO2(g)+N2(g),平衡时c (NO)与温度T的关系如下图所示,则下列说法正确的是
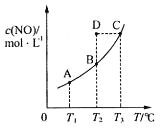
A. 该反应的△H>0
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C.在T2时,若反应体系处于状态D,则此时![]()
D.若状态B、C、D的压强分别为PB、PC 、PD ,则 PC=PD>PB
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com