
【题目】氨在国民经济中占有重要地位。
I.合成氨工业中,初始时氮气、氢气的体枳比为1:3时,每反应1mol N2,放出92.2kJ热量。如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,平衡混合物中氨的体积分数。
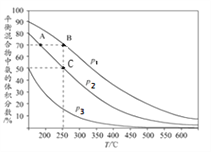
①由图可知:p1、p2、p3的大小关系为________,理由是_____________________________
②A、B点生成氨气的速率大小关系为_____________,C点,N2的转化率为_____。
③下列关于合成氨的说法正确是_________ (填序号)。
A.断开1个N≡N键的同时有6个N—H键形成,反应一定达到平衡状态
B.混合气体的平均相对分子质量不再改变状态,反应一定达到平衡状态
C.由于△H<0、△S>0,故合成氨反应一定能自发进行
D.增大n(N2):n(H2)的比值,有利用提离H2的转化率
II.最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。其电池反应为4NH3+3O2==2N2+6H2O,写出负极的电极反应式:__________________
【答案】 p1>p2>p3 相同温度下,p1到p3氨的体积分数降低,说明平衡左移,压强减小 vA<vB 66.7% BD 2NH3-6e-+6OH-==N2+6H2O
【解析】I.①由图可知:p1、p2、p3的大小关系为p1>p2>p3,理由是相同温度下,p1到p3氨的体积分数降低,说明平衡左移,压强减小。
②A、B两点中,A点对应的反应温度和压强均比B点小,所以A、B点生成氨气的速率大小关系为vA<vB。设C点对应N2的转化率为![]() ,由图可知C点对应氨的体积分数为50%,则
,由图可知C点对应氨的体积分数为50%,则![]() ,解之得N2的转化率
,解之得N2的转化率![]() 为66.7% 。
为66.7% 。
③A.断开1个N≡N键的同时有6个N—H键形成,都表示正反应速率,不能说明正反应速率和逆反应速率相等,所以反应不一定达到平衡状态,A不正确;B.该反应的正反应方向是气体分子数减小的方向,所以反应过程中混合气体的平均相对分子质量逐渐增大,当混合气体的平均相对分子质量不再改变状态时,反应一定达到平衡状态,B正确;C. 合成氨反应△H<0、△S<0,由综合判剧△H-T△S<0时反应能自发进行,所以合成氨反应在低温下能自发进行,在高温下氨易分解,C不正确;D.增大n(N2):n(H2)的比值,有利用提离H2的转化率,D正确。综上所述,关于合成氨的说法正确是BD 。
II.电池反应为4NH3+3O2==2N2+6H2O,正极的电极反应为O2+4e-+2H2O=4OH-,所以负极的电极反应式为2NH3-6e-+6OH-==N2+6H2O .


科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.1molOH﹣的质量为17gmol﹣1
B.0.5mol H2所占体积约为11.2L
C.等质量的金刚石和晶体硅所含原子个数之比为7:3
D.1mol NaCl固体溶于0.5L水中,所得溶液的物质的量浓度为2molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和NaNO3溶液中的一种。已知A、B的水溶液中水的电离程度相同,A、C溶液的pH相同,则:B是________,C是________。
(2)实验室配制FeSO4溶液,溶解时先要加入少量的稀硫酸,其原因是__________________________;配制完毕后要加入少量铁屑,其目的是__________________________。把AlCl3溶液蒸干灼烧,最后得到的主要固体产物是___________,AlCl3溶液呈酸性的原因是(用离子方程式说明)__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在一定条件下可以转化的是( )
A.CaCl2 ![]() CaCO3
CaCO3 ![]() CaO
CaO
B.Fe ![]() FeCl2
FeCl2 ![]() Fe(OH)2
Fe(OH)2
C.Al2O3 ![]() NaAlO2
NaAlO2 ![]() Al(OH)3
Al(OH)3
D.SiO2 ![]() H2SiO3
H2SiO3 ![]() Na2SiO3
Na2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某结晶水合物A含有两种阳离子和一种阴离子.将溶有90.60gA的水溶液分成两等份,向第一份逐滴加入NaOH溶液,溶液先出现白色沉淀后完全溶解,此过程中产生2.24L(标准状况)刺激性气味的气体.向第二份加入过量的Ba(OH)2溶液,过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.60g. 请回答以下问题:
(1)A的摩尔质量为 .
(2)试通过计算确定该结晶水合物的化学式为 .
(3)若第二份加入75.00mL2.00molL﹣1的Ba(OH)2溶液,则得到的沉淀质量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度小于1×10-6mol·L-1),需调节溶液pH范围为
A. (3.5 , 5.0) B. (3.5 , 7.1)
C. (5.0 , 7.1) D. ( 4.0 , 7.1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,按强电解质、弱电解质、非电解质的顺序排列的是
A. NaCl、BaSO4 、SO2
B. Cu、CH3COOH、酒精
C. 氯化钠晶体、水、酒精
D. KNO3、NH3·H2O、CaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲用98%的浓硫酸( ![]() =1.84g/mL﹣1)配制成浓度为3.68mol/L﹣1的稀硫酸500mL.请按要求填空:
=1.84g/mL﹣1)配制成浓度为3.68mol/L﹣1的稀硫酸500mL.请按要求填空:
(1)所需浓硫酸的体积为mL
(2)请将下列操作按正确的序号填在横线上:
A用量筒量取浓硫酸 B反复颠倒摇匀 C用胶头滴管加水至刻度线 D洗净烧杯内壁和玻璃棒,并将洗液转至容量瓶 E稀释浓硫酸 F将溶液转入容量瓶 G向容量瓶中加入适量蒸馏水至距离刻度线1~2cm处
其操作正确顺序为 .
(3)使用容量瓶前需要先进行操作的是 ,
(4)若实验中出现下列现象对所配溶液有什么影响?(填偏高、偏低、无影响)
①浓硫酸溶解后未冷却至室温即进行定容 ,
②定容时俯视刻度线 ,
③配制前容量瓶内有水 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com