
【题目】下列属于取代反应的是
A. 甲烷与氯气反应生成一氯甲烷 B. 乙烯与水反应生成乙醇
C. 乙醇与氧气反应生成乙醛 D. 乙烯与高锰酸钾溶液反应生成CO2
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列叙述中正确的是( )
A. 常温下64 g S4和S8混合物中含有原子数为2NA
B. 标准状况下,22.4LHF中含电子数为10NA
C. l L1 mol/L的盐酸溶液中,所含氯化氢分子数为NA
D. 足量铁在1mol氯气中加热反应,铁失去的电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下流程中a、b、c、d、e、f是六种有机物,其中a是烃类,其余是烃的衍生物。下列有关说法正确的是

A. 若a为单烯烃,则d与f的最简式一定相同
B. 若d的相对分子质量是44,则a是乙炔
C. 若a为苯乙烯(![]() ),则f的分子式是C16H32O2
),则f的分子式是C16H32O2
D. 若a的相对分子质量是42,则d是乙醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 使甲基橙变红色的溶液:Mg2+、K+、SO![]() 、NO
、NO![]()
B. 使酚酞变红色的溶液:Na+、Cu2+、HCO![]() 、NO
、NO![]()
C. 0.1 mol·L-1 AgNO3溶液:H+、K+、SO![]() 、I-
、I-
D. 0.1 mol·L-1 NaAlO2溶液:H+、Na+、Cl-、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]()
![]()
![]() (注:R、R′表示烃基),
(注:R、R′表示烃基),![]() 属于酮类,酮不发生银镜反应。今有如下变化:A(C6H12O2)
属于酮类,酮不发生银镜反应。今有如下变化:A(C6H12O2)![]()
 。已知C为羧酸,C、E都不发生银镜反应,则A的结构可能有
。已知C为羧酸,C、E都不发生银镜反应,则A的结构可能有
A. 1种 B. 2种 C. 3种 D. 4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)白色固体PCl5受热即挥发并发生分解:PCl5(g) ![]() PCl3(g)+Cl2(g)。现将5.84 g PCl5装入2.05 L真空密闭容器中,在277 ℃达到平衡,容器内压强为1.01×105 Pa,经计算可知平衡时容器内混合气体的物质的量为0.05 mol,平衡时PCl5的分解率为________。
PCl3(g)+Cl2(g)。现将5.84 g PCl5装入2.05 L真空密闭容器中,在277 ℃达到平衡,容器内压强为1.01×105 Pa,经计算可知平衡时容器内混合气体的物质的量为0.05 mol,平衡时PCl5的分解率为________。
(2)下列微粒在溶液中的还原性和氧化性强弱顺序如下:还原性HSO![]() >I-,氧化性IO
>I-,氧化性IO![]() >I2>SO
>I2>SO![]() 。向含有x mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示,则x为________mol。
。向含有x mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示,则x为________mol。

(3)甲醇对水质会造成一定的污染,可细菌的作用下,用氨(NH3)处理含甲醇(CH3OH)的工业废水,使其变成无毒的CO2和N2,从而消除对环境的污染,化学方程式为:_____________________,该过程中被氧化的元素是 ___________,当产生标准状况下2.24L![]() 时,共转移电子_______mol。
时,共转移电子_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业作出了突出贡献。以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3+CO2+H2O===NH4HCO3;NH4HCO3+NaCl===NaHCO3↓+NH4Cl;2NaHCO3![]() Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
【探究实例】
Ⅰ.原理分析 碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是________.
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,在溶液中首先结晶析出
Ⅱ.实验探究
(1)一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。

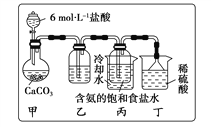
回答下列有关问题:
①丁装置中稀硫酸的作用是____________;
②实验结束后,分离出NaHCO3晶体的操作是________(填分离操作的名称)。如何进一步提纯(写出具体的操作)_________________________________________________。
(2)另一位同学用图中戊装置(其他装置未画出)进行实验。
①实验时,须先从_________管通入_______气体,再从_______管中通入_____________气体。
②有同学建议在戊装置的b导管下端连接己装置,理由是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其实验的装置如下(反应需要加热,图中省去了加热装罝):

乙醇 | 溴乙烷 | 溴 | |
状态 | 无色液体 | 无色液体 | 深红色液体 |
密度/(g cm-3) | 0.79 | 1.44 | 3. 1 |
沸点/℃ | 78.5 | 38.4 | 59 |
(1)A装置的名称是________。
(2)沸石的作用是________。
(3)己知H2SO4(浓)+NaBr![]() NaHSO4+HBr↑,写出A中生成溴乙烷的化学方程式________。
NaHSO4+HBr↑,写出A中生成溴乙烷的化学方程式________。
(4)C中收集到的粗产品混有杂质的主要成份是________;为了除去这些杂质,最好选择下列____(选填序号)溶液来洗涤所得粗产品。
A.氢氧化钠B.碘化钠C.亚硫酸钠D.碳酸氢钠
(5)粗产品洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的M固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0g。
①M固体的名称为________;
②在上述提纯过程中每次分液时,产品均从分液漏斗的________(填“上口”或“下口”)放出;
③从乙醇的角度考虑,本实验所得溴乙烷的产率是_________。
(6)该实验装罝的主要缺陷是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com