
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
分析 (1)海带中的碘是化合态形式,淀粉遇碘单质显蓝色,故可将海带中的碘元素形成碘单质的形式可检验;
(2)根据反应热=反应物的总键能-生成物的总键能计算;
(3)①根据表中数据知,反应达到平衡状态时,HI的物质的量分数是0.784,碘和氢气的物质的量分数相等为0.108,化学平衡常数K为生成物浓度幂之积与反应物浓度幂之积之比,带入计算;
②增大反应物浓度,反应正向移动;新平衡相当于对原平衡加压,该反应气体体积不变,则平衡不移动,各物质的物质的量增大,但百分量不变;
③根据化学平衡常数公式确定k逆、K、k正的关系;根据v正=k正x2(HI)计算正反应速率;
④升高温度,正、逆反应速率均加快,正反应为吸热反应,升高温度,平衡向吸热反应方向移动,正反应建立平衡,平衡时HI的物质的量分数减小,逆反应建立平衡,平衡时H2的物质的量分数增大.
解答 解:(1)海带中的碘是化合态形式,淀粉遇碘单质显蓝色,故取海带灼烧成灰,加水浸取后过滤,向滤液中加入硫酸与双氧水,再加淀粉试液变蓝,说明含有碘;
故答案为:取海带灼烧成灰,加水浸取后过滤,向滤液中加入硫酸与双氧水,再加淀粉试液变蓝,说明含有碘;
(2)设1molI2(g)分子中化学键断裂时需吸收的能量为x,反应2HI(g)═H2(g)+I2(g)的△H=+11kJ•mol-1,1molH2(g)、1molHI(g)分子中化学键断裂时分别需要吸收436KJ、299KJ的能量,则2×299-436-x=△H=+11kJ•mol-1,解得x=151;
故答案为:151;
(3)①根据表中数据知,反应达到平衡状态时,HI的物质的量分数是0.784,碘和氢气的物质的量分数相等为0.108,其化学平衡常数K=$\frac{c({H}_{2})•c({I}_{2})}{{c}^{2}(HI)}$=$\frac{0.10{8}^{2}}{0.78{4}^{2}}$;
故答案为:$\frac{0.10{8}^{2}}{0.78{4}^{2}}$;
②向平衡后体系中再加入少量HI,反应物浓度增大,瞬间反应向着正方向进行;但是该反应是个气体体积不变的反应,相当于对原平衡加压,新平衡时,各物质的物质的量增大,但是百分量不变,则HI的质量分数也不变;
故答案为:正;不变;
③该反应达到平衡状态时正逆反应速率相等,v正=k正x2(HI)=v逆=k逆x(H2)x(I2),则k逆=k正$•\frac{{x}^{2}(HI)}{x({H}_{2})x({I}_{2})}$=$\frac{{K}_{正}}{K}$,若k正=0.0027min-1,在t=40min时,v正=0.0027min-1×0.852=1.95×10-3min-1;
故答案为:$\frac{{K}_{正}}{K}$; 1.95×10-3min-1;
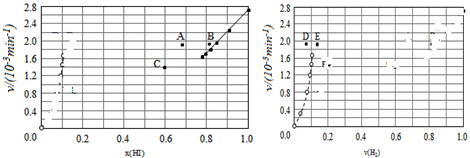
④对于2HI(g)?H2(g)+I2(g)反应建立平衡时:
升高温度,正、逆反应速率均加快,因此排除C点,正反应为吸热反应,升高温度,平衡向吸热反应方向移动,因此平衡正向移动,再次平衡时HI的物质的量分数减小,因此排除B点,故选A点;
对于H2(g)+I2(g)?2HI(g)反应建立平衡时:
升高温度,正、逆反应速率均加快,升高温度,平衡向吸热反应方向移动,因此平衡逆向移动,再次平衡时H2的物质的量分数增大,故选E点;
因此反应重新达到平衡,v正~x(HI)对应的点为A,v逆~x(H2)对应的点为E;
故答案为:A、E.
点评 本题考查化学平衡状态判断、化学平衡常数有关计算等知识点,侧重考查学生分析判断能力,易错点是平衡状态判断,注意:只有反应前后改变的物理量才能作为平衡状态判断依据,难点是(3)题计算.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:多选题
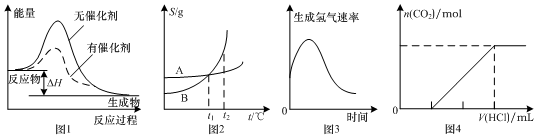
| A. | 图1表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | 图2表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| C. | 图3表示镁条放入盐酸中生成氢气速率随时间的变化,起初反应速率加快的原因可能是该反应为放热反应 | |
| D. | 图4表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1 mol•L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | ||
| X | Y | Z |
| A. | 元素X的最高价氧化物对应水化物的化学式为H3PO4 | |
| B. | 元素Y有两种常见的氧化物且都能与元素R的氢化物反应生成对应价态的酸 | |
| C. | R、X、Y三者的气态氢化物稳定性依次增强 | |
| D. | Z的单质能与Y的某些化合物发生置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入KSCN溶液,溶液变红,证明原溶液含有Fe3+ | |
| B. | 将气体通入KMnO4酸性溶液,紫色褪色,证明气体为乙烯 | |
| C. | 将气体通入澄清石灰水,有白色沉淀,证明气体为CO2 | |
| D. | 加入BaCl2溶液,沉淀不溶于盐酸,证明原溶液含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;其中所含有的化学键类型为离子键、共价键;
;其中所含有的化学键类型为离子键、共价键;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com