
【题目】下列各化合物中,能发生酯化、还原、加成、消去四种反应的是( )
A.![]()
B.![]()
C.CH3﹣CH═CH﹣CHO
D.![]()
【答案】A
【解析】解:A、 ![]() 分子中含醇羟基、醛基,醇羟基能羧酸发生酯化反应,醛基能与氢气还原反应、加成反应、醇羟基能消去反应,故A正确;
分子中含醇羟基、醛基,醇羟基能羧酸发生酯化反应,醛基能与氢气还原反应、加成反应、醇羟基能消去反应,故A正确;
B、 ![]() 分子中含醇羟基,醇羟基能羧酸发生酯化反应,醇羟基能消去反应,不能还原反应、加成反应故B错误;
分子中含醇羟基,醇羟基能羧酸发生酯化反应,醇羟基能消去反应,不能还原反应、加成反应故B错误;
C、CH3﹣CH═CH﹣CHO分子中含有碳碳双键、醛基,碳碳双键、醛基都能与氢气发生加成反应、还原反应、不能发生酯化反应、消去反应,故C错误;
D、 ![]() 分子中含醇羟基、羰基、醛基,醇羟基能羧酸发生酯化反应,羰基、醛基与氢气发生加成反应、还原反应,由于与羟基所连碳相邻的碳上没有氢原子不能发生消去反应,故D错误;
分子中含醇羟基、羰基、醛基,醇羟基能羧酸发生酯化反应,羰基、醛基与氢气发生加成反应、还原反应,由于与羟基所连碳相邻的碳上没有氢原子不能发生消去反应,故D错误;
故选A.
能发生酯化反应应具有醇羟基或羧基;还原反应是可以加氢或去氧的反应;加成反应是不饱和碳原子和其他原子或原子团结合使化学键断裂的反应;消去反应是有机物分子中消去一个小分子形成含不饱和碳原子的化合物.


科目:高中化学 来源: 题型:
【题目】锰及其化合物在现代工业及国防建设中具有十分重要的意义。回答下列问题:
(1)常用铝热法还原软锰矿(主要成分为MnO2)来制金属锰。因为铝与软锰矿反应剧烈,所以先在强热条件下将软锰矿转变为Mn3O4,然后再将其与铝粉混合。
①MnO2中Mn的化合价为____________________。
②铝粉与Mn3O4反应时,还原剂与氧化剂的物质的量之比为_________________。
(2)pH=0的溶液中,不同价态锰的微粒的能量(E)如图所示。若某种含锰微粒(如Mn3+)的能量处于相邻价态两种微粒(Mn2+和MnO2)能量连线的上方,则该该微粒不稳定,会发生歧化反应,转化为相邻价态的微粒。

①MnO42-______(填“能”或“不能”)稳定存在于pH=0的溶液中。
②实验室可利用以下反应检验Mn2+的存在:2Mn2++5S2O82-+8H2O==16H++10SO42-+2 MnO42-,确认Mn2+存在的现象是______________________;检验时必须控制Mn2+的浓度和用量,否则实验失败,理由是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸和过乙酸(过氧乙酸)都广泛用作消毒剂.
已知硫酸和过硫酸的结构简式如下:
请从以下八个式子中选择答案回答下列问题: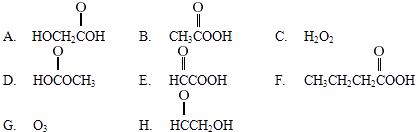
(1)乙酸结构简式为CH3COOH,含有的官能团名称是 .
(2)过乙酸(过氧乙酸)的结构简式是(答案填字母编号).
(3)过乙酸的同分异构体是(答案填字母编号).
(4)过乙酸的同系物是(答案填字母编号).
(5)中国女科学家屠呦呦获得了2015 年诺贝尔奖,主要因为其在青蒿素发现及创制方面的突出贡献.青蒿素化学结构式如图 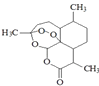 ,青蒿素分子式为 .
,青蒿素分子式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I 现有下列十种物质:①Na2O ②Cu(OH)2 ③Zn ④CaCO3 ⑤硫酸溶液 ⑥Ba(OH)2 ⑦干冰 ⑧NH3 ⑨盐酸 ⑩KHSO4
(1)其中属于电解质的有_____________(填序号)。
(2)往②中加入过量的0.1 mol/L⑩的水溶液,发生反应的离子方程式是___________,向所得溶液中继续加入③,会产生无色气泡,该反应的离子方程式是_____________________。
II 右图是某仪器的一部分,数字XY之间相差 1ml, 若是量筒的一部分且X=5,则所盛液体的体积是_______;若是滴定管的一部分且X=15,则凹液面的读数应该是_______。

III 在新疆和甘肃的交界处有一条山谷,被称为“魔鬼谷”,其地表浅处有一层磁铁矿,经常是晴天霹雳,雷雨倾盆;但树草却异常旺盛,其原因是雨水中含有一种能促进植物生长的离子是_________,当雨水浸到地表与磁铁矿接触时发生反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。某化学兴趣小组同学对氯气的性质进行如下探究:
(1)兴趣小组同学按下图装置进行实验,探究Cl2的漂白性。
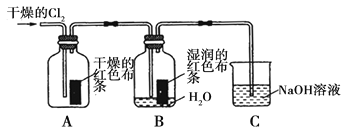
①通入Cl2 后,观察到的现象是 根据现象可得出的结论是 。
②集气瓶B发生反应的离子方程式是 。
③C装置的作用是 ,若有2.24L(标准状况下)Cl2被NaOH溶液完全吸收,则反应过程中转移的电子为 _mol。
(2)兴趣小组同学按下图装置进行实验,探究Cl2的氧化性。
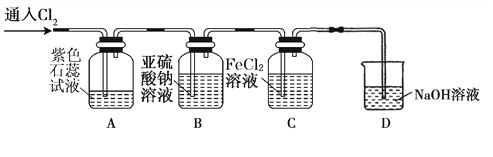
①实验开始后,观察装置A 中的现象是 。
②装置C中发生反应的离子方程式是 。
③停止通入氯气,取装置B中少量溶液于洁净的试管中,向其中滴加足量稀盐酸,再向其中滴加氯化钡溶液,有白色沉淀生成。则通入Cl2时装置B中发生 反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是
A. 往Na2SiO3溶液中加入盐酸:2Na++ SiO32- +2H+![]() H2SiO3↓+2Na+
H2SiO3↓+2Na+
B. 氯气与烧碱溶液反应:Cl2+2OH-![]() Cl-+ClO-+H2O
Cl-+ClO-+H2O
C. 稀硫酸滴在铁片上:Fe+6H+![]() 2Fe3++3H2↑
2Fe3++3H2↑
D. 铜片插入硝酸银溶液中:Cu+Ag+![]() Cu2++Ag
Cu2++Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应N2+3H2![]() 2NH3为放热反应;:
2NH3为放热反应;:
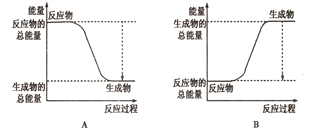
①下图能正确表示该反应中能量变化的是________;
②根据下表数据,计算生成1molNH3时该反应放出的热量为______kJ;
化学键 | H-H | N≡N | N-H |
断开1mol键所吸收的能量 | 436kJ | 946kJ | 391kJ |
③一定温度下,将3molH2和1molN2通入容积为2L的密闭容器中发生反应,5min达到平衡,测得c(NH3)=0.4mol/L,则O至5min时![]() (N2)=______,反应开始与平衡时气体的物质的量之比为__________;
(N2)=______,反应开始与平衡时气体的物质的量之比为__________;
(2)原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:
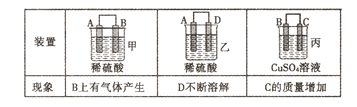
①装置甲甲SO42-向________ 极移动(填“A”或“B”);
②四种金属活动性由强到弱的顺序是____;
③若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后.取出洗净、干燥、称量.两电极质量差为6g。则导线中通过电子的物质的量为______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com