
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 主族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | H | |||||||
| 2 | D | E | F | |||||
| 3 | A | B | C | G |




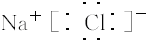
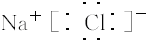
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| W | X | Y | Z | |
| 结构 或性质 |
最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最低负价之和为零 |

查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| W | X | Y | Z | |
| 结构或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正化合价与最低负化合价之和为零 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)钛元素的同位素有:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。下列说法中正确的是( )
。下列说法中正确的是( )
A.据此可计算出钛元素的相对原子质量为48
B.钛元素的五种同位素化学性质均不相同
C.钛元素在元素周期表中位于第四周期
D.钛与26Fe同为第Ⅷ族元素
(2)TiO2是高级的白色颜料,它的制取方法如下:
第一步:使钛铁矿与硫酸反应,FeTiO3+2H2SO4![]() TiOSO4+FeSO4+2H2O,此时,钛铁矿中的Fe2O3也与H2SO4发生反应,可加入铁屑使将生成的Fe3+还原成Fe2+。写出此还原过程的离子反应方程式:______________________________________________________。
TiOSO4+FeSO4+2H2O,此时,钛铁矿中的Fe2O3也与H2SO4发生反应,可加入铁屑使将生成的Fe3+还原成Fe2+。写出此还原过程的离子反应方程式:______________________________________________________。
第二步:水解,TiOSO4+2H2O![]() TiO2·H2O+H2SO4 ΔH>0。
TiO2·H2O+H2SO4 ΔH>0。
制TiO2的关键是第二步水解反应。为使第二步水解反应进行得更完全,可采用下列_______措施。
A.加酸 B.加碱 C.加热 D.加压
(3)最近发现一种由钛原子和碳原子构成的气态团簇分子,如下图所示,顶点和面心的原子是钛原子,棱的中心和体心的原子是碳原子。则它的化学式为__________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com