
| A、CH4 |
| B、O2 |
| C、Na2O2 |
| D、NH3 |
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
| A、碘131I原子核内所含中子数为78 |
| B、127I 和131I为两种核素A |
| C、碘127I原子和放射性碘原子131I属于同位素 |
| D、碘127I原子和碘131I原子的质子数不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
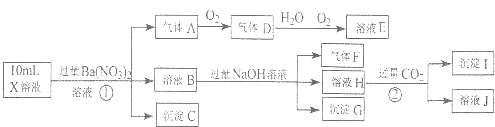
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| B、0.1mol?L-1CH3COONa溶液中:c(Na+)=c(CH3COO-)+c(OH-) |
| C、CH3COONa、NaOH和Na2CO3三种溶液的pH相同,则浓度大小顺序:c (NaOH)<c (Na2CO3)<c(CH3COONa) |
| D、向0.1mol?L-1CH3COOH溶液中滴加NaOH溶液至中性,离子浓度的关系:c(CH3COO-)>c(Na+)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,该反应的热化学方程式是 NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=+57.4 kJ?mol-1 |
| B、已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石一定比石墨稳定 |
| C、已知2H2O(g)=2H2(g)+O2(g)△H=+483.6 kJ?mol-1,则提供483.6kJ热量时,一定会使2 mol H2O(g)发生分解 |
| D、已知C(s)+O2(g)=CO2(g)△H=a kJ?mol-1,2C(s)+O2(g)=2CO(g),△H=b kJ?mol-1,则2CO(g)+O2(g)=2CO2(g)△H=(2a-b)kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两种微粒,若核外电子排布完全相同,则其化学性质一定相同 |
| B、具有相同电子数的两种微粒一定具有相同的化学性质 |
| C、两原子,如果核外电子排布相同,则一定属于同种元素 |
| D、阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硅酸钠可保存于带胶塞的试剂瓶中 |
| B、常温下,浓硫酸和浓硝酸可贮存于铁或铝制的容器中 |
| C、少量金属钠保存在四氯化碳中 |
| D、氯水保存于棕色试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com