
【题目】A、D、E、W是中学常见的四种元素,原子序数依次增大,A的原子最外层电子数是次外层的2倍,D的氧化物属于两性氧化物,D、E位于同周期,A、D、E的原子最外层电子数之和为14,W是人体必需的微量元素,缺乏W会导致贫血症状。
(1)W在元素周期表中的位置是___。A与E组成的化合物是常用的溶剂,写出其电子式___。
(2)下列事实能用元素周期表相应规律解释的是(填字母序号)___。
a.D的最高价氧化物对应水化物的碱性弱于Mg(OH)2
b.E的气态氢化物的稳定性小于HF
c.A的单质能与二氧化硅高温下制得粗品硅单质
(3)WE3的溶液可用于刻蚀铜制的印刷电路板,反应的离子方程式为____。
(4)①工业上用电解法制备D的单质,反应的化学方程式为___。
②家用“管道通”的有效成分是烧碱和D的单质,使用时需加入一定量的水,此时发生反应的化学方程式为____。
(5)W的单质可用于处理酸性废水中的NO3-,使其转换为NH4+,同时生成有磁性的W的氧化物X,再进行后续处理,上述反应的离子方程式为__。上述W的氧化物X能与D的单质反应,写出该反应的化学方程式为__。
【答案】第四周期,第VⅢ族 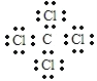 ab 2Fe3++Cu=2Fe2++Cu2+ 2Al2O3(熔融)
ab 2Fe3++Cu=2Fe2++Cu2+ 2Al2O3(熔融)![]() 4A1+3O2↑ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 3Fe+NO3-+2H++H2O=Fe3O4+NH4+ 8Al+3Fe3O4
4A1+3O2↑ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 3Fe+NO3-+2H++H2O=Fe3O4+NH4+ 8Al+3Fe3O4![]() 4Al2O3+9Fe
4Al2O3+9Fe
【解析】
A、D、E、W是中学常见的四种元素,原子序数依次增大,A的原子最外层电子数是次外层的2倍,A为C元素;D的氧化物属于两性氧化物,D为Al元素;D、E位于同周期,A、D、E的原子最外层电子数之和为14,则E的最外层电子数=14-4-3=7,E为Cl元素;W是人体必需的微量元素,缺乏W会导致贫血症状,W为Fe元素,据此分析解答。
根据上述分析,A为C元素,D为Al元素,E为Cl元素,W为Fe元素。
(1)W为Fe元素,在元素周期表中位于第四周期,第VⅢ族;A为C元素,E为Cl元素,组成的化合物是常用的溶剂为四氯化碳,电子式为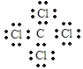 ,故答案为:第四周期,第VⅢ族;
,故答案为:第四周期,第VⅢ族; ;
;
(2)a.同周期元素,从左到右,金属性依次减弱,铝在镁的右边,所以金属性弱于镁,所以氢氧化铝的碱性弱于Mg(OH)2,故a选;b.同主族元素,从上到下,非金属性依次减弱,所以F的非金属性强于Cl,则氢化物稳定性HCl小于HF,故b选;c.高温下,碳能与二氧化硅高温下制得粗品硅单质,是因为生成的CO是气体,沸点远低于二氧化硅,不能用元素周期律解释,故c不选;故答案为:ab;
(3)FeCl3的溶液可用于刻蚀铜制的印刷电路板,是因为铁离子能够氧化铜生成铜离子,反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(4)①工业上用电解氧化铝的方法制备铝,方程式:2Al2O3(熔融)![]() 4Al+3O2↑;故答案为:2Al2O3(熔融)
4Al+3O2↑;故答案为:2Al2O3(熔融)![]() 4Al+3O2↑;
4Al+3O2↑;
②铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,生成的氢气可以有效的疏通管道,反应的化学方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(5)酸性环境下硝酸根离子具有强的氧化性,能够氧化铁生成四氧化三铁,反应的离子方程式:3Fe+NO3-+2H++H2O=Fe3O4+NH4+;铝与四氧化三铁反应生成氧化铝和铁,方程式:8Al+3Fe3O4![]() 4Al2O3+9Fe,故答案为:3Fe+NO3-+2H++H2O=Fe3O4+NH4+;8Al+3Fe3O4
4Al2O3+9Fe,故答案为:3Fe+NO3-+2H++H2O=Fe3O4+NH4+;8Al+3Fe3O4![]() 4Al2O3+9Fe。
4Al2O3+9Fe。


科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是

A. 离子半径: X>Y>Z
B. WX3和水反应形成的化合物是离子化合物
C. 最高价氧化物对应的水化物酸性:R>W
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知饱和氯化铵溶液与亚硝酸钠晶体混合加热可制备氮气。利用如下装置制取氮气,并用氮气制备Ca3N2,Ca3N2遇水发生水解反应。下列说法错误的是
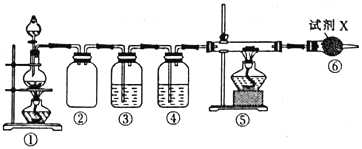
A. ①中发生的化学反应为NaNO2+NH4Cl![]() NaCl+N2↑+2H2O
NaCl+N2↑+2H2O
B. ④、⑥中依次盛装的试剂可以是浓H2SO4、碱石灰
C. ③中盛放的试剂是NaOH 溶液
D. 实验结束,取⑤中的少量产物于试管中,加适量蒸馏水,可以使试管口湿润的红色石蕊试纸变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
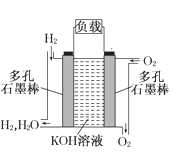
【题目】氢气被看做是理想的“绿色能源”。用高压氢气、氧气制作氢氧燃料电池是利用氢能的一种重要方式(装置如图所示)。请写出氢氧燃料电池(电解质溶液为KOH溶液)的电极反应式。正极_____________;负极_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种被称为“软电池”的纸质电池,其总反应为:Zn+2MnO2+H2O=ZnO+2MnOOH。下列说法正确的是( )

A.该电池中Zn作正极
B.Zn电极上发生还原反应
C.该电池工作时电流由Zn经导线流向MnO2
D.当6.5gZn完全溶解时,流经电路的电子个数约为1.204×l023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于恒容密闭容器中进行的可逆反应2NO2(g)![]() 2NO(g)+O2(g),下列说法中能说明反应一定已经达到化学平衡状态的是( )
2NO(g)+O2(g),下列说法中能说明反应一定已经达到化学平衡状态的是( )
①单位时间生成n mol O2的同时生成2n mol NO2;
②2v正(NO2)=v逆(O2)
③NO2、NO、O2的物质的量浓度之比为2:2:1;
④容器内压强不再改变
⑤密闭容器中混合气体的密度不再改变;
⑥混合气体的平均相对分子质量不再改变
A.①④⑥B.②③⑤C.①②⑥D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家正在研究建立如图所示的二氧化碳新循环体系以解决日益加剧的温室效应等问题,关系图中能反映的化学观点或化学思想有( )
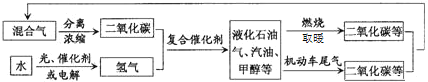
①二氧化碳也是一种重要的资源;
②光能或电能可以转化为化学能;
③燃烧时化学能可以转化为热能;
④无机物和有机物可以相互转化;
⑤化学变化中元素种类是守恒的
A.①②③B.①④⑤C.①②④⑤D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于苯乙烯(![]() )的下列叙述:
)的下列叙述:
①所有的原子不可能共面 ②可溶于水 ③可溶于苯中 ④能使酸性KMnO4溶液褪色
⑤可发生加聚反应 ⑥1mol苯乙烯与H2反应最多消耗4molH2。其中完全正确的一组是( )
A. ①②④⑤B. ③④⑤⑥C. ①③⑤⑥D. ②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海冰是海水冻结而成的咸水冰,海水冻结时,部分来不及流走的盐分(设以NaCl为主)以卤汁的形式包裹在冰晶之间,形成“盐泡”,其大致结构如图所示。若海冰的冰龄达到1年以上,则融化后的水为淡水。用NA表示阿伏加德罗常数的值,设冰的密度为0.9g/cm3。下列叙述正确的是

A.海冰内层“盐泡”越少,密度越大
B.海冰冰龄越短,内层的“盐泡”越少
C.冰的密度比水小是因为在固态冰中水分子间以氢键结合,排列更规整
D.每含1mol H2O的海冰内就有2×105 NA个NaCl分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com