
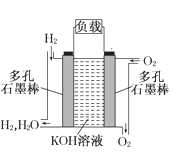
【题目】氢气被看做是理想的“绿色能源”。用高压氢气、氧气制作氢氧燃料电池是利用氢能的一种重要方式(装置如图所示)。请写出氢氧燃料电池(电解质溶液为KOH溶液)的电极反应式。正极_____________;负极_______________________。
科目:高中化学 来源: 题型:
【题目】优化反应条件是研究化学反应的重要方向。
(1)以硫代硫酸钠与硫酸的反应Na2S2O3 + H2SO4= Na2SO4 + SO2+ S↓ + H2O为例,探究外界条件对化学反应速率的影响,实验方案如下表所示。
实验 序号 | Na2S2O3溶液 | H2SO4溶液 | 蒸馏水 | 温度/℃ | ||
浓度/(mol/L) | 体积/mL | 浓度/(mol/L) | 体积/mL | 体积/mL | ||
I | 0.1 | 1.5 | 0.1 | 1.5 | 10 | 20 |
II | 0.1 | 2.5 | 0.1 | 1.5 | 9 | a |
III | 0.1 | b | 0.1 | 1.5 | 9 | 30 |
①表中,a为________________________,b为________________。
②实验表明,实验III的反应速率最快,支持这一结论的实验现象为_________________________。
(2)硫代硫酸钠可用于从含氧化银的矿渣中浸出银,反应如下:Ag2O + 4S2O32- + H2O ![]() 2[Ag(S2O3)2]3- + 2OH-,实际生产中,为了提高银的浸出率需要调节pH的范围为8.5~9.5,解释其原因________
2[Ag(S2O3)2]3- + 2OH-,实际生产中,为了提高银的浸出率需要调节pH的范围为8.5~9.5,解释其原因________
(3)工业上常用空气催化氧化法除去电石渣浆(含CaO)上清液中的S2-,并制取石膏(CaSO4·2H2O),其中的物质转化过程如下图所示。
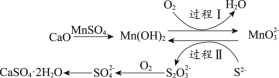
①过程I、II中,起催化剂作用的物质是_______________。
②过程II中,反应的离子方程式为_________。
③根据物质转化过程,若将10 L上清液中的S2-转化为SO42-(S2-浓度为320 mg/L),理论上共需要标准状况下的O2的体积为___________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家的研究成果往往对人类社会的进步产生重大影响,下列对应关系错误的是( )
A.舍勒首先在实验室制得了氯气
B.氧气是戴维通过实验首先发现的
C.门捷列夫绘制了第一张元素周期表
D.侯德榜研究并使纯碱的生产实现了国产化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一 制取氯酸钾和氯水
利用如图所示的实验装置进行实验。
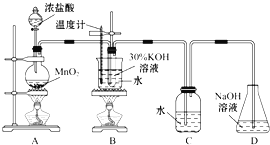
(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤。该实验操作过程需要的玻璃仪器有______。
(2)若对调B和C装置的位置,_____(填“可能”或“不可能”)提高B中氯酸钾的产率。
实验二 氯酸钾与碘化钾反应的研究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0.20molL-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0molL-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①系列a实验的实验目的是______。
②设计1号试管实验的作用是______。
③若2号试管实验现象是溶液变为黄色,取少量该溶液加入______溶液显蓝色。
实验三 测定饱和氯水中氯元素的总量
(4)根据下列资料,为该小组设计一个简单可行的实验方案(不必描述操作过程的细节):_____。
资料:①次氯酸会破坏酸碱指示剂;
②次氯酸或氯水可被SO2、H2O2和FeCl2等物质还原成Cl-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛(TiCl4)是制取航空材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3,不溶于水)制备TiCl4等产品的一种工艺流程示意如图:
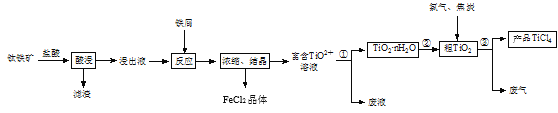
回答下列问题:
(1)“酸浸”时需要将钛铁矿粉碎,其目的是____。
(2)浸出液呈强酸性,含有TiO2+、Fe2+及少量Fe3+、Al3+等离子,则生成TiO2+的离子方程式是__。
(3)“反应”时需加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是____。
(4)通过控制条件,可以使过程①中生成的TiO2·nH2O形成一种液态分散系,用一束光照射该分散系能够产生丁达尔效应,则分散质颗粒直径的范围是____。
(5)过程①制得的固体TiO2·nH2O需用过量酸清洗以除去其中的Fe(OH)3杂质,检验Fe(OH)3杂质除净的实验方法是____。
(6)过程③生成的废气中含有CO,则TiO2和焦炭、氯气在高温下发生反应的化学方程式是___。
(7)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是____(只要求写出一项)。
(8)依据表中信息,可采用___方法精制含少量SiCl4杂质的TiCl4。
TiCl4 | SiCl4 | |
熔点/℃ | -25.0 | -68.8 |
沸点/℃ | 136.4 | 57.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A. 乙烯与苯都能使溴水褪色,但褪色原理不同
B. 1 mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗氯气 5mol
C. 溴水遇到乙醛溶液出现褪色现象,是因为发生了氧化反应
D. ![]() 与
与![]() 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、D、E、W是中学常见的四种元素,原子序数依次增大,A的原子最外层电子数是次外层的2倍,D的氧化物属于两性氧化物,D、E位于同周期,A、D、E的原子最外层电子数之和为14,W是人体必需的微量元素,缺乏W会导致贫血症状。
(1)W在元素周期表中的位置是___。A与E组成的化合物是常用的溶剂,写出其电子式___。
(2)下列事实能用元素周期表相应规律解释的是(填字母序号)___。
a.D的最高价氧化物对应水化物的碱性弱于Mg(OH)2
b.E的气态氢化物的稳定性小于HF
c.A的单质能与二氧化硅高温下制得粗品硅单质
(3)WE3的溶液可用于刻蚀铜制的印刷电路板,反应的离子方程式为____。
(4)①工业上用电解法制备D的单质,反应的化学方程式为___。
②家用“管道通”的有效成分是烧碱和D的单质,使用时需加入一定量的水,此时发生反应的化学方程式为____。
(5)W的单质可用于处理酸性废水中的NO3-,使其转换为NH4+,同时生成有磁性的W的氧化物X,再进行后续处理,上述反应的离子方程式为__。上述W的氧化物X能与D的单质反应,写出该反应的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,甘氨酸在水溶液中解离情况如下: 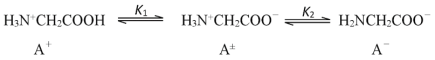 ,改变溶液pH值,三种甘氨酸相关离子的分布分数(α,平衡时某物种的浓度占各物种浓度之和的分数)变化如图所示。当调节溶液的pH值使甘氨酸所带的净电荷为零,此时溶液的pH叫等电点。下列说法正确的是
,改变溶液pH值,三种甘氨酸相关离子的分布分数(α,平衡时某物种的浓度占各物种浓度之和的分数)变化如图所示。当调节溶液的pH值使甘氨酸所带的净电荷为零,此时溶液的pH叫等电点。下列说法正确的是
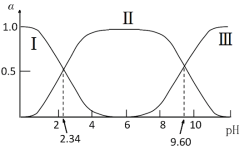
A.曲线Ⅰ、Ⅱ、Ⅲ分别代表的微粒为A-、![]() 、A+
、A+
B.K2=10-2.34,且K2对应的解离基团为—NH3+
C.在pH=9.60的溶液中加盐酸,α(![]() )+α(A+)+α(A-)保持不变
)+α(A+)+α(A-)保持不变
D.甘氨酸的等电点pH约为6,且存在c(![]() )=c(A+)=c(A-)
)=c(A+)=c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室通常用无水乙醇和浓硫酸加热到170℃制取乙烯,反应方程式为:CH3CH2OH![]() CH2=CH2↑+H2O。若温度过高或加热时间过长,制得的乙烯往往混有CO2、SO2、H2O(g)。
CH2=CH2↑+H2O。若温度过高或加热时间过长,制得的乙烯往往混有CO2、SO2、H2O(g)。
(1)试用下图所示的装置设计一个实验,验证制得的气体中含有杂质气体:二氧化碳,二氧化硫和水蒸气,按气流的方向,各装置的连接顺序是 。

(2)实验时若观察到:①中A瓶中溶液褪色,B瓶中溶液颜色逐渐变浅,C瓶中溶液不褪色,则B瓶的作用是 ,C瓶的作用是 。
(3)若气体通过装置③中所盛溶液时,产生白色沉淀,它可以用来验证的气体是____。
(4)装置②中所加的试剂名称是____ _______。
(5)乙烯在一定条件下能制得聚乙烯,写出相应的化学反应方程式: 。
(6)某同学做此实验时发现装置④存在的不妥之处是: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com