
����Ŀ��ʵ����ͨ������ˮ�Ҵ���Ũ������ȵ�170����ȡ��ϩ,��Ӧ����ʽΪ��CH3CH2OH![]() CH2��CH2����H2O�����¶ȹ������ʱ��������Ƶõ���ϩ��������CO2��SO2��H2O��g����
CH2��CH2����H2O�����¶ȹ������ʱ��������Ƶõ���ϩ��������CO2��SO2��H2O��g����
��1��������ͼ��ʾ��װ�����һ��ʵ�飬��֤�Ƶõ�������������������:������̼�����������ˮ�������������ķ���װ�õ�����˳���� ��

��2��ʵ��ʱ���۲쵽������Aƿ����Һ��ɫ��Bƿ����Һ��ɫ��dz��Cƿ����Һ����ɫ����Bƿ�������� ��Cƿ�������� ��
��3��������ͨ��װ�â�����ʢ��Һʱ��������ɫ������������������֤��������____��
��4��װ�â������ӵ��Լ�������____ _______��
��5����ϩ��һ�����������Ƶþ���ϩ��д����Ӧ�Ļ�ѧ��Ӧ����ʽ�� ��
��6��ijͬѧ����ʵ��ʱ����װ�âܴ��ڵIJ���֮���ǣ� ��
���𰸡���1���ܢڢ٢� ��2��B����ȥ������SO2 ��C������SO2 �Ƿ����
��3��CO2 ��4����ˮ����ͭ ��5��nCH2=CH2![]()
![]() ��6����װ����ȱ���¶ȼ�
��6����װ����ȱ���¶ȼ�
��������
�����������1���ڼ�����������ʱ���ܻ�����ˮ������Ӧ���ȼ���ˮ��������ϩ��SO2����ʹ��ˮ���������Һ��ɫ���ټ���SO2��Ȼ���ȥSO2��������ϩ�������������̼�����Ը�װ�õ�����˳�����ܢڢ٢ۣ�
��2��ʵ��ʱ���۲쵽������Aƿ����Һ��ɫ��Bƿ����Һ��ɫ��dz��Cƿ����Һ����ɫ����Aƿ�������Ǽ����Ƿ���SO2��Bƿ�������dz�ȥ������SO2��Cƿ�������Ǽ���SO2 �Ƿ������
��3��������ͨ��װ�â�����ʢ��Һʱ��������ɫ������������������֤��������CO2��
��4��װ�â�����ˮ���������������ӵ��Լ���������ˮ����ͭ��
��5����ϩ�����Ӿ۷�Ӧ�ķ���ʽΪnCH2=CH2![]()
![]() ��
��
��6������ˮ�Ҵ���Ũ������ȵ�170����ȡ��ϩ������װ����ȱ���¶ȼơ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
��1����Է�������Ϊ72������������һ�ȴ���ֻ��һ�֣��������Ľṹ��ʽΪ ��
��2��ij��̬������һ��̬ϩ����ɵĻ��������ͬ�¡�ͬѹ�¶�����������ܶ�Ϊ13��ȡ��״���´˻������4.48 L��ͨ����������ˮ����ˮ��������2.8 g���������������Ϊ �������ʽ����
��3��ij����һ�ֱ�ˮ�����״Һ�壬��Է�������Ϊ78��̼Ԫ������Ԫ�ص�������Ϊ12:1������ʹ��ˮ�����Ը��������Һ��ɫ��д����������ȡ����Ӧ�Ļ�ѧ����ʽ(����дһ������) ��
��4��2.3gij�л���A��ȫȼ�պ�����0.1 mol CO2�� 2.7gH2O����øû���������������������ܶ���1.6����֪���л�����Է�����������Ӧ��д���˷�Ӧ�Ļ�ѧ����ʽ ��
��5�� �л���Ľṹ���á�����ʽ����ʾ���磺![]() �ɼ�дΪ
�ɼ�дΪ![]()
![]() �ɼ�дΪ
�ɼ�дΪ ![]() ��õ�����ζ�����а����rϩ���rϩ�ļ���ʽ����ͼ��
��õ�����ζ�����а����rϩ���rϩ�ļ���ʽ����ͼ��![]() ���rϩ�ķ���ʽΪ ��
���rϩ�ķ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������⻯��NH3��N2H4���ڹ�ũҵ���������պ���������й㷺Ӧ�á�
��1��Һ����Ϊһ��DZ�ڵ��������ȼ����Խ��Խ���о���Ա���ӡ����ڰ�ȫ�ԡ��۸�ȷ���ϻ�ʯȼ�Ϻ���ȼ�����Žϴ�����ơ�����ȼ��ʵ���漰����������صķ�Ӧ��
��4NH3(g)��5O2(g)��4NO(g)��6H2O(l) ��H1
��4NH3(g)��6NO(g)��5N2(g)��6H2O(l) ��H2
��Ӧ 4NH3(g)��3O2(g)��2N2(g)��6H2O(l) ��H�� �������ú�����H1����H2��ʽ�ӱ�ʾ��
��2���ϳɰ�ʵ���У������Ϊ3 L�ĺ����ܱ������У�Ͷ��4 mol N2��9 mol H2��һ�������ºϳɰ���ƽ��ʱ���ı��¶Ȳ�õ��������±���ʾ��
�¶�(K) | ƽ��ʱNH3�����ʵ���(mol) |
T1 | 2.4 |
T2 | 2.0 |
��֪���ƻ�1 mol N2(g)��3 mol H2(g)�еĻ�ѧ�����ĵ�������С���ƻ�2 mol NH3(g)�еĻ�ѧ�����ĵ�������
����T1 T2��������������<������=������
����T2 K�£�����10min�ﵽ��ѧƽ��״̬����0~10min��H2��ƽ������v(H2)= ��ƽ��ʱN2��ת��������N2��= ��
������ͼ��ֱ�����ʱ䣨��H�����������ƽ����Է���������![]() ����N2�����������N2���������ܶȣ������뷴Ӧʱ��Ĺ�ϵ��������ȷ���ܱ����ÿ��淴Ӧ�ﵽƽ��״̬���� ��
����N2�����������N2���������ܶȣ������뷴Ӧʱ��Ĺ�ϵ��������ȷ���ܱ����ÿ��淴Ӧ�ﵽƽ��״̬���� ��

��3��ijN2H4���»�������ȼ�ϵ�أ������ȶ�������Ⱦ�����ʣ�ԭ����ͼ1��ʾ��

��M�������ĵ缫��ӦʽΪ ��
���������������Դ����ͼ2װ�õ�ⱥ���Ȼ�����Һ���缫��Ϊ���Ե缫�����豥���Ȼ�����Һ���Ϊ500mL������Һ��pHֵ��Ϊ13ʱ���ڳ����²ⶨ��������ȼ�ϵ�ص�����������Ϊ80%����������N2H4������Ϊ g��������Һ���ǰ��������䣩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�ѧ��Ӧ������ת�������֪ʶ���Իش���������:
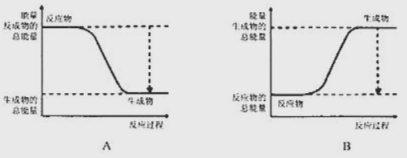
��1����֪![]() �����ױȰ����ȶ����ṹ��ʯī���ƣ���ͼ����ȷ��ʾ�÷����������仯����___������ţ���
�����ױȰ����ȶ����ṹ��ʯī���ƣ���ͼ����ȷ��ʾ�÷����������仯����___������ţ���
��2����֪������ȼ�ϵ�ص��ܷ�Ӧ����ʽΪ2H2O+O2=2H2O���ڼ��������£�ͨ������һ�˵ĵ缫��ӦʽΪ_________________����·��ÿת��0.2mol���ӣ���״��������H2�������______L��
��3����֪�Ͽ�1mol N��N����Ҫ946kJ���������Ͽ�1mol H��H����Ҫ436kJ������������1moN��H���ų�391kJ���������Լ�������2mol NH3ʱ��______����ų��������ա���______kJ������������ͬ���������������г���1molN2��3molH2ʱ�����Ƿ�Ӧ��Ӧ������______������ڡ��������ڡ���С�ڡ��������������ֵ��ԭ����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ��ѡ��5�л���ѧ������
�����ؾ��п�ͻ���Ԥ�����������ã���ϳ�·�����£�

��֪��
i��1 mol G���������Na��NaOH��NaHCO3�����ʵ����ֱ�Ϊ3 mol��2 mol��1 mol��
ii��![]()
iii�� ��R1��R2��R3Ϊ��������ԭ�ӣ� ��ش�
��R1��R2��R3Ϊ��������ԭ�ӣ� ��ش�
��1��B��C����Ӧ������ ��
��2��C��D��Ӧ�Ļ�ѧ����ʽ�� ��
��3��E�ĺ˴Ź����������������壬E�к��еĹ����������� ��
E��G��Ӧ�Ļ�ѧ����ʽ�� ��
��4�������й�����ȩ����������ȷ���� ��
a������ȩ����NaHCO3��Һ��Ӧ
b������ȩ����Ũ��ˮ����ȡ����Ӧ
c��1 mol����ȩ�������3 molH2�����ӳɷ�Ӧ
��5��д��һ�ַ�����������������ȩ��ͬ���칹��Ľṹ��ʽ ��
�������ϵ�һ����ȡ������2��
��1 mol������ˮ�⣬�������3 molNaOH
��6�������صķ�������2���������ṹ��ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ijʵ��С���H2O2�ķֽ���������̽�����±��Ǹ�ʵ��С���о�Ӱ��H2O2�ֽ����ʵ�����ʱ��¼��һ�����ݣ���������ͬ�ķ�ĩ״�Ϳ�״��MnO2�ֱ����ʢ��15 ml 5%��H2O2��Һ�Ĵ��Թ��У����ô����ǵ�ľ�����ԣ�������£�
MnO2 | �����Թ���� | �۲��� | ��Ӧ��������ʱ�� |
��ĩ״ | ���� | ���ҷ�Ӧ�������ǵ�ľ����ȼ | 3.5min |
��״ | �� | ��Ӧ���������Ǻ�����ľ��δ��ȼ | 30min |
��1��д������ʵ���з�����Ӧ�Ļ�ѧ����ʽ�� ��
��2��ʵ���������������Ĵ�Ч���� �йء�
��ij��Ӧ�����Ϊ5L�ĺ����ܱ������н��У� ��0-3�����ڸ����ʵ����ı仯���������ͼ��ʾ��A��B��C��Ϊ���壬��A��������ɫ����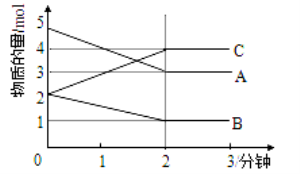
��3���÷�Ӧ�ĵĻ�ѧ����ʽΪ ��
��4����Ӧ��ʼ��2����ʱ��B��ƽ����Ӧ����Ϊ ��
��5����˵���÷�Ӧ�Ѵﵽƽ��״̬���� ��
a��v(A)= 2v(B) b�������ڸ����ʵ����ʵ������
c��v��(A)=v��(C) d���������������ɫ���ֲ���
��6����ͼ���ƽ��ʱA��ת����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z��W��ԭ��������������X��ԭ�Ӱ뾶��YС��X��Wͬ���壬Z�ǵؿ��к�����ߵ�Ԫ�ء�X��Y��Z��Wԭ������������֮��Ϊ13���ʣ�
��1��X�� Y�� Z�� W�� ����Ԫ�ط��ţ�
��2��д��W������������Ӧ��ˮ����ĵ���ʽ ��д��Y�ļ��⻯��ĵ���ʽ ��
��3��Y������������Ӧ��ˮ�����Ũ��Һ���ú���ֻ�ɫ��д��������Ӧ�Ļ�ѧ����ʽ ��
��4��ʵ������ȡY���⻯��ķ���ʽ ���÷�Ӧ ����������������������������ԭ��Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��M��G����Ԫ�ط������������ڣ���ԭ��������������X��Zͬ���壬���γ����ӻ�����ZX��Y��Mͬ���壬���γ�MY2��MY3���ַ��ӡ�
��ش��������⣺
��1��Y��Ԫ�����ڱ��е�λ��Ϊ________________��
��2������Ԫ�ص�����������Ӧ��ˮ����������ǿ����_______________��д��ѧʽ�����ǽ�����̬�⻯�ﻹԭ����ǿ����__________________��д��ѧʽ����
��3��Y��G�ĵ��ʻ���Ԫ��֮���γɵĻ��������ˮ����������___________��д�������������ʵĻ�ѧʽ����
��4��Z2Y2�еĻ�ѧ��������_____________________��Z2Y2��ˮ��Ӧ�ų���������ӷ���ʽΪ
________ _____��
��5�� ����״̬�£�Z�ĵ��ʺ�FeG2����ɿɳ���أ�װ��ʾ��ͼ���£�����Ӧԭ��Ϊ��
2Z + FeG2![]() Fe + 2ZG �ŵ�ʱ����صĸ�������Ϊ______������ ��Ӧ
Fe + 2ZG �ŵ�ʱ����صĸ�������Ϊ______������ ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����Ӧ3A(g)��B(g) ===2C(g)�����ֲ�ͬ�������½��з�Ӧ����ͬһʱ��������õķ�Ӧ�����ò�ͬ�����ʱ�ʾΪ��vA��1 mol/(L��min)����vC��0.5 mol/(L��min)����vB��0.5 mol/(L��min)����������¸÷�Ӧ����������С�Ĺ�ϵ�� ��������ű�ʾ��
��2��ij�¶�ʱ����һ��5L�ĺ��������У�X��Y��Z��Ϊ���壬�������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ������ͼ��������գ�

���÷�Ӧ�Ļ�ѧ����ʽΪ____________________________��
����Ӧ��ʼ��2min��������Z��ʾ��ƽ����Ӧ����Ϊ ��
��2min��Ӧ��ƽ�������ڻ�������ƽ����Է����������� ʼʱ �������С������ȡ���ͬ������������ܶȱ���ʼʱ ��
��������Ӧ���ڵ�2minʱ��X��ת����Ϊ ��
����a mol X��b mol Y�Ļ�����巢��������Ӧ����Ӧ��ijʱ�̸����ʵ���ǡ�����㣺n (X) = n (Y) = n (Z)����ԭ���������a : b =__________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com