
����Ŀ�����ݻ�ѧ��Ӧ������ת�������֪ʶ���Իش���������:
��1����֪![]() �����ױȰ����ȶ����ṹ��ʯī���ƣ���ͼ����ȷ��ʾ�÷����������仯����___������ţ���
�����ױȰ����ȶ����ṹ��ʯī���ƣ���ͼ����ȷ��ʾ�÷����������仯����___������ţ���
��2����֪������ȼ�ϵ�ص��ܷ�Ӧ����ʽΪ2H2O+O2=2H2O���ڼ��������£�ͨ������һ�˵ĵ缫��ӦʽΪ_________________����·��ÿת��0.2mol���ӣ���״��������H2�������______L��
��3����֪�Ͽ�1mol N��N����Ҫ946kJ���������Ͽ�1mol H��H����Ҫ436kJ������������1moN��H���ų�391kJ���������Լ�������2mol NH3ʱ��______����ų��������ա���______kJ������������ͬ���������������г���1molN2��3molH2ʱ�����Ƿ�Ӧ��Ӧ������______������ڡ��������ڡ���С�ڡ��������������ֵ��ԭ����______��
���𰸡���1��A
��2��H2-2e-+2OH- =2H2O ��2.24��
��3���ų���92��С�ڣ����淴Ӧ����Ӧ�ﲻ����ȫת��Ϊ��������
��������
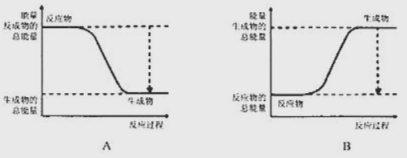
�����������1�����ʺ��е�����Խ�ͣ����ʵ��ȶ��Ծ�Խǿ�����ں��ױȰ����ȶ����������������\�ĸߣ�����ת��Ϊ�\�ķ�Ӧ�Ƿ��ȷ�Ӧ������ȷ��ʾ�÷����������仯����Aͼ��2������ȼ�ϵ�ص��ܷ�Ӧ����ʽΪ2H2O+O2=2H2O���ڼ��������£�ͨ������һ���Ǹ����������ĵ缫��ӦʽΪH2-2e-+2OH- =2H2O�������ܷ�Ӧ����ʽ��֪��ÿ��2mol����������Ӧ��ת�Ƶ��ӵ����ʵ�����4mol�����·��ÿת��0.2mol���ӣ���Ӧ���ı�״����H2�����ʵ�����0.1mol���������V=0.1mol�� 22.4L/mol=2.24L����3����֪�Ͽ�1mol N��N����Ҫ946kJ���������Ͽ�1mol H��H����Ҫ436kJ������������1moN��H���ų�391kJ������������ݷ�Ӧ����ʽN2(g)+3H2(g)=2NH3(g)��֪������2mol NH3ʱH=946kJ/mol+3��436kJ/mol-6��391kJ/mol=-92kJ/mol�������ų�92kkJ������������ͬ���������������г���1molN2��3molH2ʱ�����ڸ÷�Ӧ�ǿ��淴Ӧ����Ӧ�ﲻ����ȫת��Ϊ������������Ƿ�Ӧ��Ӧ������С���������ֵ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȩ�����������ζ�����������ϡ�ϴ�Ӽ��ͻ�ױƷ�����ϡ��ϳ�����ȩ��·����ͼ��ʾ(�����Լ�������δע��)��

��֪��![]()
![]()
��ش��������⣺
��1��D�Ľṹ��ʽ��_______________��
��2������E�Ļ�ѧ����ʽ��___________________________________________��
��3�������й�G��������,����ȷ����______(�����)��
A��G��������4�ֲ�ͬ��ѧ��������ԭ��
B��G�ܷ�����ȥ��Ӧ��������Ӧ�ͻ�ԭ��Ӧ
C��1molG�������5molH2�����ӳɷ�Ӧ
��4��H��ͬ���칹���ж��֣���д����������������һ�ֽṹ��ʽ��__________��
����FeCl3��Һ����ɫ�����˴Ź���������������������ԭ�ӵ����շ塣
��5����F��Gת���Ĺ����У������з���ʽΪC17H22O�ĸ�����K������K�Ľ�
����ʽ��___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D��E���ֶ�����Ԫ�أ����ǵĺ˵������C��A��B��D��E��˳������C��D���ֱܷ���A��ԭ�Ӹ�����Ϊ1��1 ��2��1�γɻ����CB����EA2��Ӧ����C2A����̬����EB4��E��M���������K���������2����
��1��д��������Ԫ�ص����ƣ�A ��B ��C ��D ��E ��
��2������E��ԭ�ӽṹʾ��ͼ ��д������ʽD2A2 ��EB4 ��
��3���Ƚ�EA2��EB4���۵�ߵ�(�ѧʽ) > ��
��4��д��D������CuSO4��Һ��Ӧ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ����ǻ�ѧ�������һ���ش��ס�ij��ȤС��Ϊ�о�ԭ���ԭ���������ͼװ�ã�

��1��a��b������ʱ���ձ��������� ��
��2��a��b�õ������ӣ�Cu��Ϊԭ���_________�����������������
�缫��ӦʽΪ�� ����Һ��H+����____________
���Cu����Zn������������ܷ�ӦʽΪ�� ��
���������Һ��ΪAgNO3��Һ����ת��0.2mol����ʱ����������CuƬ�����仯Ϊ___ ___g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Ǹ����ڳ�ʪ��������绯ѧ��ʴ��ʾ��ͼ�������ķ�ӦΪ��
2Fe��2H2O��O2��2Fe(OH)2��Fe(OH)2����������ΪFe(OH)3��Fe(OH)3��ˮ�������⡣�����ͼʾ���ش��������⣺

��1���������绯ѧ��ʴ�У�̼��C���� ����
��2��д�������ĵ缫��Ӧʽ ��
��3����ҵ�ϣ����ڸ����豸�ı���Ϳһ���ͣ��������� ��
A�����ٸ����������ˮ�ĽӴ�����ֹ�ڸ��������γ�Сԭ���
B�����������������ˮ�ĽӴ�����ֹ�ڸ��������γ�С����
C�����豸����ֹ�ҳ���Ⱦ
D����ֹ��Ϊ�Ӵ��豸�������豸��ʴ
��4����������ڽ����ں�ˮ�еĸ���բ�������Դ���ӷ�����Ӧ��բ�������ⲿֱ����Դ�� ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ����Ҫ�Ļ���ԭ�ϣ����Ʊ�ԭ���ǣ�
![]()
![]()
���¶��Ըߵ�����»����ɸ���������������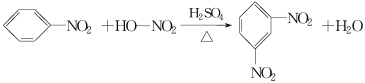
�뽫�����Ʊ���������ʵ��������д������
��1����������ƣ�ȡ100 mL�ձ�����Ũ����20 mL��Ũ����18 mL���ƻ��ᣬ���������Ϊ__________________________________
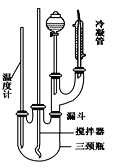
��2����װ��Ӧװ�ã���ͼ��ʾ��װʵ��װ�ã������ʵ���������ܵ������� _
��3����Ӧ���裺�ٰ�18 mL�ı����뵽����ƿ�У���������뵽��Һ©���У���εμӻ��ᣬ�ߵμӱ߽��裬��������Ŀ����____________________________ _
�ڻ���μ���Ϻ��ڼ��Ƚ���������·�Ӧ��Сʱ�����Ƽ����¶ȵķ�����___ ____ ��
�۷�����ᴿ����ȥ������û�з�Ӧ���ᣬ���ڲ����м������Һ��Ȼ���÷�Һ©����Һ��______������Ϊ�ֲ�Ʒ����ȥ��������û�з�Ӧ�ı������ɵĸ�����ļ�㷽����(�������)__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����ͨ������ˮ�Ҵ���Ũ������ȵ�170����ȡ��ϩ,��Ӧ����ʽΪ��CH3CH2OH![]() CH2��CH2����H2O�����¶ȹ������ʱ��������Ƶõ���ϩ��������CO2��SO2��H2O��g����
CH2��CH2����H2O�����¶ȹ������ʱ��������Ƶõ���ϩ��������CO2��SO2��H2O��g����
��1��������ͼ��ʾ��װ�����һ��ʵ�飬��֤�Ƶõ�������������������:������̼�����������ˮ�������������ķ���װ�õ�����˳���� ��

��2��ʵ��ʱ���۲쵽������Aƿ����Һ��ɫ��Bƿ����Һ��ɫ��dz��Cƿ����Һ����ɫ����Bƿ�������� ��Cƿ�������� ��
��3��������ͨ��װ�â�����ʢ��Һʱ��������ɫ������������������֤��������____��
��4��װ�â������ӵ��Լ�������____ _______��
��5����ϩ��һ�����������Ƶþ���ϩ��д����Ӧ�Ļ�ѧ��Ӧ����ʽ�� ��
��6��ijͬѧ����ʵ��ʱ����װ�âܴ��ڵIJ���֮���ǣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧһѡ��5���л���ѧ������
������A(C8H8O3)���ɶ�������Ҷ���������������������������͡������������ϡ���ױƷ�����ϣ�Ҳ������ȡֹʹҩ��ɱ����ȡ���A����������ͼ��ʾת����ϵ(���ַ�Ӧ��������ȥ)��

��֪������Ϣ��
��F�DZ��ӣ�
��A�ĺ˴Ź������ױ����������ֲ�ͬ��ѧ�������⣬��1mol A����ˮ��Ӧ�������2mol Br2��
�����������ʯ�ҹ��ȿɷ������ȷ�Ӧ����ʵ�����Ƽ��飺CH3COONa+NaOH![]() CH4��+Na2CO3
CH4��+Na2CO3
�ش��������⣺
��1��A�Ľṹ��ʽΪ________________________��
��2��B��D�ķ�Ӧ����ʽΪ_____________________��
��3��F��H�ķ�Ӧ����Ϊ_____________________��H������Ϊ___________________��
��4��C��E�ķ�Ӧ����ʽΪ________________________��
��5��A��ͬ���칹���б�����ֻ������ȡ�������ܷ���������Ӧ����ɫ��Ӧ�Ĺ�_________�֣����к˴Ź��������а��ֲ�ͬ��ѧ�����������__________________(д�ṹ��ʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ�����ͪ�ķ�Ӧԭ����

�䷴Ӧ��װ��ʾ��ͼ�������г�װ�á�����װ����ȥ����

������������ͪ������ʳ��ˮ��ˮ�IJ����������ʼ��±���ע�������е����ݱ�ʾ���л�����ˮ�γɵľ��й̶���ɵĻ����ķе���
���� | �е������� | �ܶ���g��cm��3, 20���� | �ܽ��� |
������ | 161.1��97.8�� | 0.962 | ������ˮ |
����ͪ | 155.6��95�� | 0.948 | ����ˮ |
����ʳ��ˮ | 108.0 | 1.330 | |
ˮ | 100.0 | 0.998 |
��1��ʵ����ͨ��װ��B������Na2Cr2O7��Һ�ӵ�ʢ�л�������A�У���55��60�����з�Ӧ����Ӧ��ɺ�������ˮ�������ռ�95 ~ 100������֣��õ���Ҫ������ͪ��Ʒ��ˮ�Ļ���
�� ����B�������� ��
�� �������ʱ��һ��ʱ�����δͨ����ˮ��Ӧ��ȡ����ȷ������ ��
�� �����ܷ��뻷��ͪ��ˮ��ԭ���� ��
��2������ͪ���ᴿ��Ҫ��������һϵ�еIJ�����
a�������ռ�151~ 156����֣��õ���Ʒ
b������
c�����ռ����Ĵ�Ʒ�м�NaCl���������ͣ����ã���Һ
d��������ˮMgSO4���壬��ȥ�л���������ˮ
�� ������������ȷ˳���� �����������
�� ����������c������NaCl����������� ��

��3������ͪ��һ�ֳ��õ���ȡ�����Ի���ͪΪ�ɷ�֮һ����ȡҺ�Խ�����������ȡ����pH�Ĺ�ϵ����ͼ������ij�ܿ�ʯ���������Һ, ����Һ���е���������Ҫ��H+��Co2+��Mn2+��Al3+����ȥAl3+ ����������ȡ�������MnCl2�Եõ���Ϊ������CoCl2��Һ��pH��Χ������ ��
a��2.0��2.5 b��3.0��3.5 c��4.0��4.5
��4����ʵ����ԭ��������20mL������������Na2Cr2O7��Һ10mL�����ճƵò�Ʒ����Ϊ14.7g������������ͪ�IJ���Ϊ ���ٷ�����ȷ��0.1����
��5��ʵ������ĺ�����Һ����Ⱦ����������Cr2O72��ת��ΪCr3������ת��ΪCr��OH��3������ȥ��ΪʹCr3��Ũ��С��1��10-5mol/L��Ӧ������Һ��pH=___________������֪��������Cr��OH��3��Ksp��6.4��10-31�� lg2=0.3 lg5=0.7��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com