
����Ŀ����ͼ�Ǹ����ڳ�ʪ��������绯ѧ��ʴ��ʾ��ͼ�������ķ�ӦΪ��
2Fe��2H2O��O2��2Fe(OH)2��Fe(OH)2����������ΪFe(OH)3��Fe(OH)3��ˮ�������⡣�����ͼʾ���ش��������⣺

��1���������绯ѧ��ʴ�У�̼��C���� ����
��2��д�������ĵ缫��Ӧʽ ��
��3����ҵ�ϣ����ڸ����豸�ı���Ϳһ���ͣ��������� ��
A�����ٸ����������ˮ�ĽӴ�����ֹ�ڸ��������γ�Сԭ���
B�����������������ˮ�ĽӴ�����ֹ�ڸ��������γ�С����
C�����豸����ֹ�ҳ���Ⱦ
D����ֹ��Ϊ�Ӵ��豸�������豸��ʴ
��4����������ڽ����ں�ˮ�еĸ���բ�������Դ���ӷ�����Ӧ��բ�������ⲿֱ����Դ�� ����
���𰸡���1������2��Fe��2e��= Fe2+ ��3��A ��4����
��������
�����������1�����ڳ�ʪ��������绯ѧ��ʴ����������������ʴ��C��������
��2�������ĵ缫��ӦʽΪFe��2e��= Fe2+ ��
��3����ҵ�ϣ����ڸ����豸�ı���Ϳһ���ͣ��������Ǽ��ٸ����������ˮ�ĽӴ�����ֹ�ڸ��������γ�Сԭ��أ�
��4����������ڽ����ں�ˮ�еĸ���բ�������Դ���ӷ�����Ӧ��բ�������ⲿֱ����Դ���������÷�������ӵ�����������������


 ͬ����ϰǿ����չϵ�д�
ͬ����ϰǿ����չϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ơ����˽𡱣���ѧ�ɷ���FeS2�������������徧ϵ������������Ϊ�ǻ������ʡ��¶����ߺ��û��á��ڿ����������������������Ͷ���������Ҫ���ڽӴ����������

�ش��������⣺
��1����FeS2�е�S2-�ĺ�������Ų�ʽ��________________________��
��2��������Fe3+��Fe2+Ҫ�����ȶ���ԭ����__________________________________��
��3����FeS2��ϡ���ᷴӦ�õ�H2S2��H2S2�����У����ۼ���������___________________��FeS2�����õ�SO2����SO2�����е�Sԭ�ӵ��ӻ����������______________________ ��д��������SO2��Ϊ�ȵ�����ķ��ӻ�����_______________________��-
��4��H2SO4��H2SO3����S�ĺ����ᣬ���ýṹ֪ʶ����H2SO4��H2SO3����ǿ��ԭ��
_____________________________________________________________________��
��5��FeS2�ľ����е�Fe2+���ӵ����з�ʽ����ͼ��
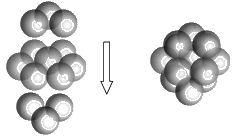
��ÿ��Fe2+��Χ����ĵȾ����S22-������____________����
����֪FeS2�ľ���������a0=0.54nm�������ܶ�Ϊ_____________________g��cm-3(��ʽ�����㣬�����ӵ�����Ϊ6.02��1023)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2015��ŵ��������ѧ��ҽѧ�������й�ҩѧ���������Լ���������ѧ�����������������ձ���ѧ�Ҵ���ǣ����������ڼ����漲�������о�����ȡ�õijɾ͡������������Եط����������أ�������ű�������·�������ͼΪ�����أ����ڸ����ʵ�����˵����ȷ����

A�������ػ�ѧʽΪC15H20O5
B���ڹ��������¿��ܷ���ȡ����Ӧ
C�����������������ӳɷ�Ӧ
D��ˮ�����������ű�������õ���Ч
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������⻯��NH3��N2H4���ڹ�ũҵ���������պ���������й㷺Ӧ�á�
��1��Һ����Ϊһ��DZ�ڵ��������ȼ����Խ��Խ���о���Ա���ӡ����ڰ�ȫ�ԡ��۸�ȷ���ϻ�ʯȼ�Ϻ���ȼ�����Žϴ�����ơ�����ȼ��ʵ���漰����������صķ�Ӧ��
��4NH3(g)��5O2(g)��4NO(g)��6H2O(l) ��H1
��4NH3(g)��6NO(g)��5N2(g)��6H2O(l) ��H2
��Ӧ 4NH3(g)��3O2(g)��2N2(g)��6H2O(l) ��H�� �������ú�����H1����H2��ʽ�ӱ�ʾ��
��2���ϳɰ�ʵ���У������Ϊ3 L�ĺ����ܱ������У�Ͷ��4 mol N2��9 mol H2��һ�������ºϳɰ���ƽ��ʱ���ı��¶Ȳ�õ��������±���ʾ��
�¶�(K) | ƽ��ʱNH3�����ʵ���(mol) |
T1 | 2.4 |
T2 | 2.0 |
��֪���ƻ�1 mol N2(g)��3 mol H2(g)�еĻ�ѧ�����ĵ�������С���ƻ�2 mol NH3(g)�еĻ�ѧ�����ĵ�������
����T1 T2��������������<������=������
����T2 K�£�����10min�ﵽ��ѧƽ��״̬����0~10min��H2��ƽ������v(H2)= ��ƽ��ʱN2��ת��������N2��= ��
������ͼ��ֱ�����ʱ䣨��H�����������ƽ����Է���������![]() ����N2�����������N2���������ܶȣ������뷴Ӧʱ��Ĺ�ϵ��������ȷ���ܱ����ÿ��淴Ӧ�ﵽƽ��״̬���� ��
����N2�����������N2���������ܶȣ������뷴Ӧʱ��Ĺ�ϵ��������ȷ���ܱ����ÿ��淴Ӧ�ﵽƽ��״̬���� ��

��3��ijN2H4���»�������ȼ�ϵ�أ������ȶ�������Ⱦ�����ʣ�ԭ����ͼ1��ʾ��

��M�������ĵ缫��ӦʽΪ ��
���������������Դ����ͼ2װ�õ�ⱥ���Ȼ�����Һ���缫��Ϊ���Ե缫�����豥���Ȼ�����Һ���Ϊ500mL������Һ��pHֵ��Ϊ13ʱ���ڳ����²ⶨ��������ȼ�ϵ�ص�����������Ϊ80%����������N2H4������Ϊ g��������Һ���ǰ��������䣩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���ij��ȤС��ͨ��ʵ���õ���ͬ�������ϡ����������Ӧ��ʵ�����ݣ�
ʵ�� ��� | ���� ����/g | ���� ״̬ | c(H2SO4) mol/L | ʵ�� �¶�/�� | ������ʧ ��ʱ��/s |
1 | 0.10 | ˿ | 0.7 | 20 | 250 |
2 | 0.10 | ˿ | 1.0 | 20 | 200 |
3 | 0.10 | ��ĩ | 1.0 | 20 | 125 |
4 | 0.10 | ��ĩ | 1.0 | 30 | 50 |
�����������ݣ��ش��������⣺
��1����Ӧ�����ӷ���ʽ�� ��
��2����ʵ��1��2�ɵó��Ľ����ǣ�����Ũ��Խ ����Ӧ����Խ����
��ʵ��2��3�ɵó��Ľ����Ƿ�Ӧ��Ӵ���Խ��Ӧ����Խ ��
��ʵ��3��4�ɵó��Ľ������¶�Խ ����Ӧ����Խ�졣
��3���������ۺ�ϡ���ᷴӦ��ȡH2��ʵ������л��Ƴ�����H2�������V����ʱ�䣨t���Ĺ�ϵ��ͼ��ʾ�� �Է����ж�OE�Ρ�EF�Ρ�FG�Ρ�GH�η�Ӧ���ʣ��ֱ���v (OE)��v (EF)��v (FG)�� (GH)��ʾ�����ʱ���� ��
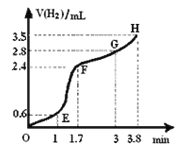
A��v (OE) B��v (EF) C��v (FG) D��v (GH)
��1min�ڷ�Ӧ������ԭ����: ��
һ��ʱ���Ӧ���Լӿ��ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�ѧ��Ӧ������ת�������֪ʶ���Իش���������:
��1����֪![]() �����ױȰ����ȶ����ṹ��ʯī���ƣ���ͼ����ȷ��ʾ�÷����������仯����___������ţ���
�����ױȰ����ȶ����ṹ��ʯī���ƣ���ͼ����ȷ��ʾ�÷����������仯����___������ţ���
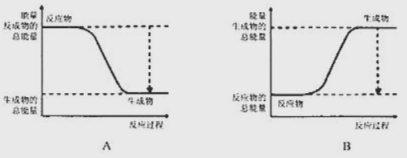
��2����֪������ȼ�ϵ�ص��ܷ�Ӧ����ʽΪ2H2O+O2=2H2O���ڼ��������£�ͨ������һ�˵ĵ缫��ӦʽΪ_________________����·��ÿת��0.2mol���ӣ���״��������H2�������______L��
��3����֪�Ͽ�1mol N��N����Ҫ946kJ���������Ͽ�1mol H��H����Ҫ436kJ������������1moN��H���ų�391kJ���������Լ�������2mol NH3ʱ��______����ų��������ա���______kJ������������ͬ���������������г���1molN2��3molH2ʱ�����Ƿ�Ӧ��Ӧ������______������ڡ��������ڡ���С�ڡ��������������ֵ��ԭ����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ��ѡ��5�л���ѧ������
�����ؾ��п�ͻ���Ԥ�����������ã���ϳ�·�����£�

��֪��
i��1 mol G���������Na��NaOH��NaHCO3�����ʵ����ֱ�Ϊ3 mol��2 mol��1 mol��
ii��![]()
iii�� ��R1��R2��R3Ϊ��������ԭ�ӣ� ��ش�
��R1��R2��R3Ϊ��������ԭ�ӣ� ��ش�
��1��B��C����Ӧ������ ��
��2��C��D��Ӧ�Ļ�ѧ����ʽ�� ��
��3��E�ĺ˴Ź����������������壬E�к��еĹ����������� ��
E��G��Ӧ�Ļ�ѧ����ʽ�� ��
��4�������й�����ȩ����������ȷ���� ��
a������ȩ����NaHCO3��Һ��Ӧ
b������ȩ����Ũ��ˮ����ȡ����Ӧ
c��1 mol����ȩ�������3 molH2�����ӳɷ�Ӧ
��5��д��һ�ַ�����������������ȩ��ͬ���칹��Ľṹ��ʽ ��
�������ϵ�һ����ȡ������2��
��1 mol������ˮ�⣬�������3 molNaOH
��6�������صķ�������2���������ṹ��ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z��W��ԭ��������������X��ԭ�Ӱ뾶��YС��X��Wͬ���壬Z�ǵؿ��к�����ߵ�Ԫ�ء�X��Y��Z��Wԭ������������֮��Ϊ13���ʣ�
��1��X�� Y�� Z�� W�� ����Ԫ�ط��ţ�
��2��д��W������������Ӧ��ˮ����ĵ���ʽ ��д��Y�ļ��⻯��ĵ���ʽ ��
��3��Y������������Ӧ��ˮ�����Ũ��Һ���ú���ֻ�ɫ��д��������Ӧ�Ļ�ѧ����ʽ ��
��4��ʵ������ȡY���⻯��ķ���ʽ ���÷�Ӧ ����������������������������ԭ��Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���༰�仯���ﱻ�㷺Ӧ���ڰ뵼�塢������������Ǧп�����̳�Ϊԭ�Ͽ��Ʊ�GeO2���乤������ͼ���¡�

��֪��GeO2�����������GeCl4��ˮ�⣬�е�86.6��
��1��������������Ҫ�ɷ���_____________���ѧʽ����ʵ������ȡ�����õ��IJ���������__________________��
��2����������ȡʱ�������ȡ����Vˮ��/V�л�����ˮ����л������ �������Ĺ�ϵ����ͼ��ʾ���������ɱ��Ƕȿ��ǣ������˵�Vˮ��/V�л�����ֵΪ ��

��3����������������������__________________________________�������㼴������Ӧ�����¶ȵķ�������Χ____________________________��
��4����������Ӧ�Ļ�ѧ����ʽ_______________________________��
��5��������������ô��������ƻ�ԭΪGe2+���õ�����Һ��ָʾ������c mol/L����ر���Һ�ζ����������VmL,�г��̳���������������ļ���ʽ________�����йط�ӦʽΪ��3Ge2++IO3-+6H+��3Ge4++I-+3H2O��IO3-+5I-+6H+��3I2+3H2O����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com