
【题目】四氯化钛(TiCl4)是制取航空材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3,不溶于水)制备TiCl4等产品的一种工艺流程示意如图:
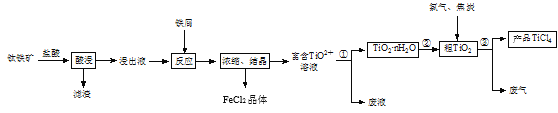
回答下列问题:
(1)“酸浸”时需要将钛铁矿粉碎,其目的是____。
(2)浸出液呈强酸性,含有TiO2+、Fe2+及少量Fe3+、Al3+等离子,则生成TiO2+的离子方程式是__。
(3)“反应”时需加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是____。
(4)通过控制条件,可以使过程①中生成的TiO2·nH2O形成一种液态分散系,用一束光照射该分散系能够产生丁达尔效应,则分散质颗粒直径的范围是____。
(5)过程①制得的固体TiO2·nH2O需用过量酸清洗以除去其中的Fe(OH)3杂质,检验Fe(OH)3杂质除净的实验方法是____。
(6)过程③生成的废气中含有CO,则TiO2和焦炭、氯气在高温下发生反应的化学方程式是___。
(7)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是____(只要求写出一项)。
(8)依据表中信息,可采用___方法精制含少量SiCl4杂质的TiCl4。
TiCl4 | SiCl4 | |
熔点/℃ | -25.0 | -68.8 |
沸点/℃ | 136.4 | 57.6 |
【答案】增大接触面积,加快反应速率 FeTiO3+4H+=TiO2++Fe2++2H2O 将Fe3+还原为Fe2+ 10-9~10-7m 用试管取少量最后一次洗涤液,加入KSCN溶液,若溶液未变为血红色,则说明Fe(OH)3杂质已除净 TiO2+2C+2Cl2![]() TiCl4+2CO 过程③中产生的CO和残留的Cl2有毒,污染空气 蒸馏
TiCl4+2CO 过程③中产生的CO和残留的Cl2有毒,污染空气 蒸馏
【解析】
(1)将钛铁矿粉碎,可以增大固体反应物的接触面积,加快反应速率;
故答案为:增大接触面积,加快反应速率;
(2)根据已知信息,确定部分反应物FeTiO3和生成物TiO2+、Fe2+,再结合元素守恒,电荷守恒配平生成TiO2+的离子方程式为FeTiO3+4H+=TiO2++Fe2++2H2O;
故答案为:FeTiO3+4H+=TiO2++Fe2++2H2O;
(3)根据题意:浸出液中含有少量Fe3+,而浸出液加入铁粉后浓缩、结晶得到FeCl2晶体,因此加入铁粉的目的是将Fe3+还原为Fe2+,加入铁屑至浸出液显紫色,说明Fe3+已完全被还原为Fe2+;
故答案为:将Fe3+还原为Fe2+;
(4)能够产生丁达尔效应的分散系为胶体,则分散质颗粒直径的范围是10-9~10-7m;
故答案为:10-9~10-7m;
(5)过量酸将Fe(OH)3中和为Fe3+,用试管取少量最后一次洗涤液,加入KSCN溶液,若溶液未变为血红色,则说明Fe(OH)3杂质已除净;
故答案为:用试管取少量最后一次洗涤液,加入KSCN溶液,若溶液未变为血红色,则说明Fe(OH)3杂质已除净;
(6)过程③反应物为TiO2、氯气、焦炭,生成的废气中含有CO,根据得失电子守恒、元素守恒写出方程式,则TiO2和焦炭、氯气在高温下发生反应的化学方程式是TiO2+2C+2Cl2![]() TiCl4+2CO;
TiCl4+2CO;
故答案为:TiO2+2C+2Cl2![]() TiCl4+2CO;
TiCl4+2CO;
(7)依据绿色化学理念,该工艺流程中存在的不足之处是过程③中产生的CO和残留的Cl2有毒,污染空气;
故答案为:过程③中产生的CO和残留的Cl2有毒,污染空气;
(8)SiCl4、TiCl4为液态混合物,沸点相差较大,因此可用蒸馏的方法提纯TiCl4;
故答案为:蒸馏。


科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数为NA,则下列说法正确的是( )
A.36.5gHCl中H+数目为NA
B.标准状况下,22.4L氨水中含有NA个NH3分子
C.常温常压下,1.6gO2和O3的混合气体中含有氧原子数为0.1 NA
D.0.1 mol·L—1NaCl溶液中阴离子总数为0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1×105Pa和298K时,将1mol气态AB分子分离成气态A原子和B原子所需要的能量称为键能(kJ·mol-1)。下面是一些共价键的键能:(已知氨分子中有三个等价的氮氢共价键)
共价键 | H2分子 | N2分子 | NH3分子 |
键能(kJ·mol-1) | 436 | 945 | 391 |
(1)根据上表中的数据判断工业合成氨的反应是__(填“吸热”或“放热”)反应;
(2)在298K时,取1molN2和3molH2放入一密闭容器中,在催化剂存在下进行反应,理论上生成2molNH3时放出或吸收的热量为Q,则Q为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知饱和氯化铵溶液与亚硝酸钠晶体混合加热可制备氮气。利用如下装置制取氮气,并用氮气制备Ca3N2,Ca3N2遇水发生水解反应。下列说法错误的是
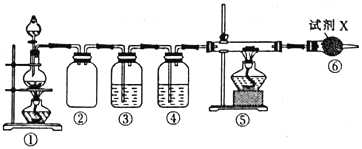
A. ①中发生的化学反应为NaNO2+NH4Cl![]() NaCl+N2↑+2H2O
NaCl+N2↑+2H2O
B. ④、⑥中依次盛装的试剂可以是浓H2SO4、碱石灰
C. ③中盛放的试剂是NaOH 溶液
D. 实验结束,取⑤中的少量产物于试管中,加适量蒸馏水,可以使试管口湿润的红色石蕊试纸变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。下图表示一个电解池,其中a为电解质溶液, X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
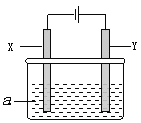
(1)X的电极名称是____________(填写“阳极”或“阴极”)。
(2)若X、Y都是惰性电极,a是饱和食盐水,实验开始时,同时在两边各滴入几滴酚酞试液,一段时间后,在X极附近观察到的现象是_____________________________,Y极上的电极反应式为____________。
(3)若X、Y都是惰性电极,a是CuSO4溶液,电解一段时间后,阳极上产生气体的体积为0.224L(标准状况下),则阴极上析出金属的质量为_________g。
(4)若要用该装置电解精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是__________,Y电极的材料是____________。
(5)若要用电镀方法在铁表面镀一层金属银,应该选择的方案是___________。
方案 | X | Y | a溶液 |
A | 银 | 石墨 | AgNO3 |
B | 银 | 铁 | AgNO3 |
C | 铁 | 银 | Fe(NO3)3 |
D | 铁 | 银 | AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
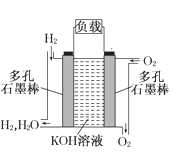
【题目】氢气被看做是理想的“绿色能源”。用高压氢气、氧气制作氢氧燃料电池是利用氢能的一种重要方式(装置如图所示)。请写出氢氧燃料电池(电解质溶液为KOH溶液)的电极反应式。正极_____________;负极_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种被称为“软电池”的纸质电池,其总反应为:Zn+2MnO2+H2O=ZnO+2MnOOH。下列说法正确的是( )

A.该电池中Zn作正极
B.Zn电极上发生还原反应
C.该电池工作时电流由Zn经导线流向MnO2
D.当6.5gZn完全溶解时,流经电路的电子个数约为1.204×l023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家正在研究建立如图所示的二氧化碳新循环体系以解决日益加剧的温室效应等问题,关系图中能反映的化学观点或化学思想有( )
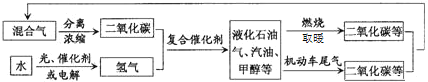
①二氧化碳也是一种重要的资源;
②光能或电能可以转化为化学能;
③燃烧时化学能可以转化为热能;
④无机物和有机物可以相互转化;
⑤化学变化中元素种类是守恒的
A.①②③B.①④⑤C.①②④⑤D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,3-二异丙烯基苯是工业上常用的交联剂,可用于制备高性能超分子聚合物,其结构如图所示。下列有关1,3-二异丙烯基苯的说法错误的是( )
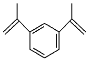
A.其一氯代物有6种
B.与液溴混合后加入铁粉可发生取代反应
C.分子中所有碳原子可能处于同一平面
D.能发生加聚反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com