
【题目】在1×105Pa和298K时,将1mol气态AB分子分离成气态A原子和B原子所需要的能量称为键能(kJ·mol-1)。下面是一些共价键的键能:(已知氨分子中有三个等价的氮氢共价键)
共价键 | H2分子 | N2分子 | NH3分子 |
键能(kJ·mol-1) | 436 | 945 | 391 |
(1)根据上表中的数据判断工业合成氨的反应是__(填“吸热”或“放热”)反应;
(2)在298K时,取1molN2和3molH2放入一密闭容器中,在催化剂存在下进行反应,理论上生成2molNH3时放出或吸收的热量为Q,则Q为___。
【答案】放热 93kJ
【解析】
(1)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式以及反应物、生成物的键能分别计算吸收和放出的能量,以此计算判断吸热还是放热;
(2)根据反应热=反应物总键能-生成物总键能计算生成2molNH3时的能量变化。
(1)在反应N2+3H2![]() 2NH3中,断裂1mol N
2NH3中,断裂1mol N![]() N键、3mol H-H键共吸收的能量为945kJ+3×436kJ=2253kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应;
N键、3mol H-H键共吸收的能量为945kJ+3×436kJ=2253kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应;
(2)反应热=反应物总键能-生成物总键能,反应N2+3H2![]() 2NH3
2NH3 ![]() ,即理论上生成2molNH3时放出的热量Q为93kJ。
,即理论上生成2molNH3时放出的热量Q为93kJ。


科目:高中化学 来源: 题型:
【题目】关于下列粒子的描述不正确的是( )
A. PH3的电子式为![]() ,其热稳定性不如NH3
,其热稳定性不如NH3
B. HS-的电子式为![]() ,是含有极性键的18电子的粒子
,是含有极性键的18电子的粒子
C. CH2Cl2的电子式为![]() ,是结构呈正四面体的分子
,是结构呈正四面体的分子
D. KF的电子式为![]() ,它是易溶于水的离子化合物
,它是易溶于水的离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工原料异丁烯(C4H8)可由异丁烷(C4H10)直接催化脱氢制备:C4H10(g) ![]() C4H8(g) + H2(g)ΔH=+139 kJ/mol
C4H8(g) + H2(g)ΔH=+139 kJ/mol
(1)该反应的化学平衡常数的表达式为_________________。
(2)一定条件下,以异丁烷为原料生产异丁烯。温度、压强改变对异丁烷平衡转化率的
影响如下图所示。
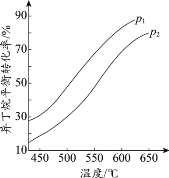
①判断p1、p2的大小关系:p1_________________(填“>”或“<”)p2,理由是_________________。
②若异丁烷的平衡转化率为40%,则平衡混合气中异丁烯的物质的量分数最多为______%(保留小数点后1位)。
(3)目前,异丁烷催化脱氢制备异丁烯的研究热点是催化活性组分以及载体的选择。下表是以V-Fe-K-O为催化活性物质,反应时间相同时,测得的不同温度、不同载体条件下的数据。
温度/℃ | 570 | 580 | 590 | 600 | 610 | |
以γ-Al2O3为载体 | 异丁烷转化率/% | 36.41 | 36.49 | 38.42 | 39.23 | 42.48 |
异丁烯收率/% | 26.17 | 27.11 | 27.51 | 26.56 | 26.22 | |
以TiO2为载体 | 异丁烷转化率/% | 30.23 | 30.87 | 32.23 | 33.63 | 33.92 |
异丁烯收率/% | 25.88 | 27.39 | 28.23 | 28.81 | 29.30 | |
说明:收率=(生产目标产物的原料量/原料的进料量)×100%
①由上表数据,可以得到的结论是____________(填字母序号)。
a.载体会影响催化剂的活性
b. 载体会影响催化剂的选择性
c.载体会影响化学平衡常数
②分析以γ-Al2O3为载体时异丁烯收率随温度变化的可能原因:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol·L-1 NaOH溶液滴定20.00mL 0.1000 mol·L-1某酸(HA)溶液,溶液中HA、A-的物质的量分数δ(X)随pH的变化如图所示。[已知δ(X)=![]() ]下列说法正确的是
]下列说法正确的是
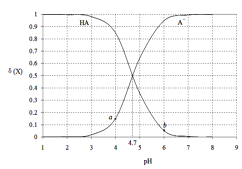
A.Ka(HA)的数量级为10-5
B.溶液中由水电离出的c(H+):a点>b点
C.当pH=4.7时,c(A-)+c(OH-)=c(HA)+c(H+)
D.当pH=7时,消耗NaOH溶液的体积为20.00mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有室温下四种溶液,有关叙述不正确的是
编号 | ① | ② | ③ | ④ |
pH | 10 | 10 | 4 | 4 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A. 相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
C. ①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D. VaL④溶液与VbL②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va︰Vb=9︰11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家的研究成果往往对人类社会的进步产生重大影响,下列对应关系错误的是( )
A.舍勒首先在实验室制得了氯气
B.氧气是戴维通过实验首先发现的
C.门捷列夫绘制了第一张元素周期表
D.侯德榜研究并使纯碱的生产实现了国产化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铅蓄电池电解AgNO3、Na2SO3的溶液,a、b、c、d电极材料均为石墨。已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,通电时a电极质量增加,下列说法正确的是( )
2PbSO4+2H2O,通电时a电极质量增加,下列说法正确的是( )
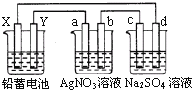
A. X极为负极
B. 放电时铅蓄电池正极的电极反应式为:PbO2+4H++SO42+4e==PbSO4+2H2O
C. c、d电极产生气体的物质的量之比为1:2
D. 电路中通过1 mol电子时,Y电极质量增加48 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛(TiCl4)是制取航空材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3,不溶于水)制备TiCl4等产品的一种工艺流程示意如图:
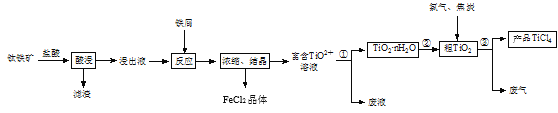
回答下列问题:
(1)“酸浸”时需要将钛铁矿粉碎,其目的是____。
(2)浸出液呈强酸性,含有TiO2+、Fe2+及少量Fe3+、Al3+等离子,则生成TiO2+的离子方程式是__。
(3)“反应”时需加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是____。
(4)通过控制条件,可以使过程①中生成的TiO2·nH2O形成一种液态分散系,用一束光照射该分散系能够产生丁达尔效应,则分散质颗粒直径的范围是____。
(5)过程①制得的固体TiO2·nH2O需用过量酸清洗以除去其中的Fe(OH)3杂质,检验Fe(OH)3杂质除净的实验方法是____。
(6)过程③生成的废气中含有CO,则TiO2和焦炭、氯气在高温下发生反应的化学方程式是___。
(7)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是____(只要求写出一项)。
(8)依据表中信息,可采用___方法精制含少量SiCl4杂质的TiCl4。
TiCl4 | SiCl4 | |
熔点/℃ | -25.0 | -68.8 |
沸点/℃ | 136.4 | 57.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)重整制取H2,具有无毒、无刺激性等优点。回答下列问题:
(1) CH3OCH3和O2发生反应Ⅰ: CH3OCH3(g)+![]() O2 (g) =2CO(g)+3H2(g) △H
O2 (g) =2CO(g)+3H2(g) △H
己知:CH3OCH3(g) =CO(g)+H2(g)+CH4(g) △H= a kJ/mol
CH4(g) +![]() O2 (g) = CO(g)+2H2O(g) △H= b kJ/mol
O2 (g) = CO(g)+2H2O(g) △H= b kJ/mol
H2(g)+![]() O2 (g) = H2O(g) △H= c kJ/mol
O2 (g) = H2O(g) △H= c kJ/mol
①则反应Ⅰ的△H=_________________ (用含a、b、c的代数式表示)。
②保持温度和压强不变,分别按不同进料比通入CH3OCH3和O2,发生反应Ⅰ。测得平衡时H2的体积百分含量与进料气中![]() 的关系如图(a)所示。当
的关系如图(a)所示。当![]() >0.6时,H2的体积百分含量快速降低,其最主要原因是_____
>0.6时,H2的体积百分含量快速降低,其最主要原因是_____![]() 填标号
填标号![]() 。
。
a 过量的O2起稀释作用
b 过量的O2与H2发生副反应生成H2O
c ![]() >0.6时平衡向逆反应方向移动
>0.6时平衡向逆反应方向移动
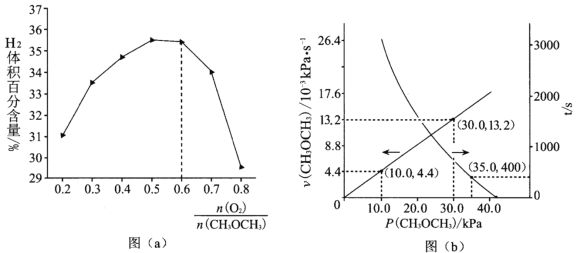
(2)T℃时,在刚性反应器中通入CH3OCH3,发生反应Ⅱ:CH3OCH3(g) =CO(g)+H2(g)+CH4(g) △H>0,测得容器内初始压强为41.6kPa,反应过程中反应速率v(CH3OCH3)、时间t与分压P(CH3OCH3)的关系如图(b)所示。
①t=400s时,CH3OCH3的分解率α=______(保留2位有效数字);
②反应速率满足v(CH3OCH3)=k Pn(CH3OCH3),n=_____,k=______s-1;400s时v(CH3OCH3)=___________kPa·s-1。
③一段时间后反应达到平衡,测得体系的总压强为121.6 kPa,则该反应的平衡常数Kp=_____kPa2。
④若提高该刚性反应器的温度,再次达到平衡后体系的压强P_____121.6 kPa(填“大于”、“等于”或“小于”),原因是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com