
����Ŀ��������(CH3OCH3)������ȡH2�����������̼��Ե��ŵ㡣�ش��������⣺
(1) CH3OCH3��O2������Ӧ�� CH3OCH3(g)+![]() O2 (g) =2CO(g)+3H2(g) ��H
O2 (g) =2CO(g)+3H2(g) ��H
��֪��CH3OCH3(g) =CO(g)+H2(g)+CH4(g) ��H= a kJ/mol
CH4(g) +![]() O2 (g) = CO(g)+2H2O(g) ��H= b kJ/mol
O2 (g) = CO(g)+2H2O(g) ��H= b kJ/mol
H2(g)+![]() O2 (g) = H2O(g) ��H= c kJ/mol
O2 (g) = H2O(g) ��H= c kJ/mol
����Ӧ�����H=_________________ (�ú�a��b��c�Ĵ���ʽ��ʾ)��
�ڱ����¶Ⱥ�ѹǿ���䣬�ֱ𰴲�ͬ���ϱ�ͨ��CH3OCH3��O2��������Ӧ���ƽ��ʱH2������ٷֺ������������![]() �Ĺ�ϵ��ͼ(a)��ʾ����
�Ĺ�ϵ��ͼ(a)��ʾ����![]() >0.6ʱ��H2������ٷֺ������ٽ��ͣ�������Ҫԭ����_____
>0.6ʱ��H2������ٷֺ������ٽ��ͣ�������Ҫԭ����_____![]() ����
����![]() ��
��
a ������O2��ϡ������
b ������O2��H2��������Ӧ����H2O
c ![]() >0.6ʱƽ�����淴Ӧ�����ƶ�
>0.6ʱƽ�����淴Ӧ�����ƶ�
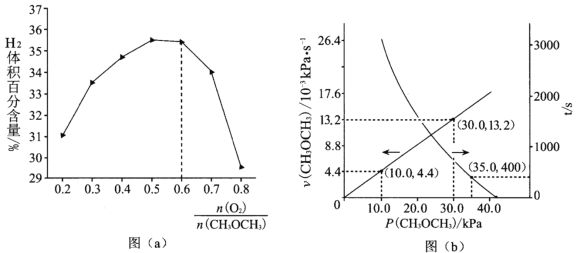
(2)T��ʱ���ڸ��Է�Ӧ����ͨ��CH3OCH3��������Ӧ��CH3OCH3(g) =CO(g)+H2(g)+CH4(g) ��H>0����������ڳ�ʼѹǿΪ41.6kPa����Ӧ�����з�Ӧ����v(CH3OCH3)��ʱ��t���ѹP(CH3OCH3)�Ĺ�ϵ��ͼ(b)��ʾ��
��t=400sʱ��CH3OCH3�ķֽ�����=______(����2λ��Ч����)��
�ڷ�Ӧ��������v(CH3OCH3)=k Pn(CH3OCH3)��n=_____��k=______s-1��400sʱv(CH3OCH3)=___________kPa��s-1��
��һ��ʱ���Ӧ�ﵽƽ�⣬�����ϵ����ѹǿΪ121.6 kPa����÷�Ӧ��ƽ�ⳣ��Kp=_____kPa2��
������߸ø��Է�Ӧ�����¶ȣ��ٴδﵽƽ�����ϵ��ѹǿP_____121.6 kPa��������������������������С��������ԭ����________��
���𰸡�(a+b-2c)kJ/mol b 16% 1 0.00044 0.0154 40000 ���� �¶���ߣ�������䣬��ѹǿ���;��Ӧ��Ϊ���ȷ�Ӧ���¶���ߣ�ƽ�����ƣ���ϵ���ʵ������ӣ���ѹǿ���
��������
CH3OCH3��O2������Ӧ�� CH3OCH3(g)+![]() O2 (g) =2CO(g)+3H2(g) ��H
O2 (g) =2CO(g)+3H2(g) ��H
��֪��CH3OCH3(g) =CO(g)+H2(g)+CH4(g) ��H= a kJ/mol
CH4(g) +![]() O2 (g) = CO(g)+2H2O(g) ��H= b kJ/mol
O2 (g) = CO(g)+2H2O(g) ��H= b kJ/mol
H2(g)+![]() O2 (g) = H2O(g) ��H= c kJ/mol
O2 (g) = H2O(g) ��H= c kJ/mol
(1)�٢�CH3OCH3(g)�TCO(g)+H2(g)+CH4(g)��H��a kJ/mol����CH4(g) +![]() O2 (g) = CO(g)+2H2O(g) ��H��b kJ/mol����H2(g)+
O2 (g) = CO(g)+2H2O(g) ��H��b kJ/mol����H2(g)+![]() O2 (g) = H2O(g) ��H��c kJ/mol�����ݸ�˹���ɢ�+�ک�����2����÷�Ӧ��CH3OCH3(g)+
O2 (g) = H2O(g) ��H��c kJ/mol�����ݸ�˹���ɢ�+�ک�����2����÷�Ӧ��CH3OCH3(g)+![]() O2 (g)�T2CO(g)+3H2(g)���ʱ���H��
O2 (g)�T2CO(g)+3H2(g)���ʱ���H��
�ڵ�![]() ��0.6ʱ��H2������ٷֺ������ٽ��͵�ԭ����������������������˷�Ӧ��
��0.6ʱ��H2������ٷֺ������ٽ��͵�ԭ����������������������˷�Ӧ��
(2)��t��400sʱ��CH3OCH3��ѹP(CH3OCH3)��35.0kPa����������ڳ�ʼѹǿΪ41.6 kPa��ת���ʣ�![]() ��100%��
��100%��![]() ��100%��
��100%��
�ڷ�Ӧ��������v(CH3OCH3)��kPn(CH3OCH3)����(10.0��4.4)��(30.0��13.2)������ֵ����v(CH3OCH3)��kPn(CH3OCH3)�У�����k��n�������õ�v(CH3OCH3)��P(CH3OCH3)�Ĺ�ϵʽ��������400sʱ��v(CH3OCH3)��
�۴ﵽƽ��ʱ�������ϵ����ѹǿP�ܣ�121.6 kPa��������м���õ����ʵ�������ƽ���ѹ�����뷴Ӧ��ƽ�ⳣ��Kp��![]() �м���Kp��
���Kp��
�������¶ȣ�����������䣬��ѹǿ����ͬʱ��Ӧ��CH3OCH3(g)�TCO(g)+H2(g)+CH4(g)��H��0�����������¶ȣ�ƽ�������ƶ�����������ʵ������������ѹǿ����
(1)��CH3OCH3(g)�TCO(g)+H2(g)+CH4(g)��H��a kJ/mol����CH4(g) +![]() O2 (g) = CO(g)+2H2O(g) ��H��b kJ/mol����H2(g)+
O2 (g) = CO(g)+2H2O(g) ��H��b kJ/mol����H2(g)+![]() O2 (g) = H2O(g) ��H��c kJ/mol�����ݸ�˹���ɢ�+�ک�����2���㷴Ӧ��CH3OCH3(g)+
O2 (g) = H2O(g) ��H��c kJ/mol�����ݸ�˹���ɢ�+�ک�����2���㷴Ӧ��CH3OCH3(g)+![]() O2 (g)�T2CO(g)+3H2(g)���ʱ���H��(a+b��2c)KJ/mol��
O2 (g)�T2CO(g)+3H2(g)���ʱ���H��(a+b��2c)KJ/mol��
����ͼ�������֪����![]() ��0.6ʱ��H2������ٷֺ������ٽ��͵�ԭ������ǣ�������O2��H2��������Ӧ����H2O���ʴ�Ϊ��b��
��0.6ʱ��H2������ٷֺ������ٽ��͵�ԭ������ǣ�������O2��H2��������Ӧ����H2O���ʴ�Ϊ��b��
(2)��t��400 sʱ��CH3OCH3��ѹP(CH3OCH3)��35.0kPa����������ڳ�ʼѹǿΪ41.6 kPa��ת���ʣ�![]() ��100%��16%��
��100%��16%��
�ڷ�Ӧ��������v(CH3OCH3)��kPn(CH3OCH3)����(10.0��4.4)��(30.0��13.2)������ֵ����v(CH3OCH3)��kPn(CH3OCH3)���У�10.0nk��4.4��10��3��30.0nk��13.2��10��4�����k��0.00044��n��1������v(CH3OCH3)��0.00044P(CH3OCH3)��400 sʱ��P(CH3OCH3)��35.0KPa����v(CH3OCH3)��0.00044��35.0��0.0154kPa/s��
�۴ﵽƽ��ʱ�������ϵ����ѹǿP�ܣ�121.6 kPa��������м���õ����ʵ�������CH3OCH3���ʵ���Ϊ1mol����Ӧ���ļ������ʵ���Ϊx��
CH3OCH3(g)CO(g)+H2(g)+CH4(g)
��ʼ��(mol) 1 0 0 0
�仯��(mol) x x x x
ƽ����(mol) 1��x x x x
���������ѹǿ֮�ȵ����������ʵ���֮����(1+2x)��1��121.6��41.6�����x��0.96mol��1��x��0.04mol�����������ʵ�����1+2x��2.92mol��Kp�� kPa2��40000kPa2���ʴ�Ϊ��40000��
kPa2��40000kPa2���ʴ�Ϊ��40000��
�������¶ȣ�����������䣬��ѹǿ����ͬʱ��Ӧ��CH3OCH3(g)�TCO(g)+H2(g)+CH4(g)��H��0������������������������¶ȣ�ƽ�������ƶ�����������ʵ������������ѹǿ����


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��105Pa��298Kʱ����1mol��̬AB���ӷ������̬Aԭ�Ӻ�Bԭ������Ҫ��������Ϊ����(kJ��mol-1)��������һЩ���ۼ��ļ��ܣ�(��֪���������������ȼ۵ĵ���ۼ�)
���ۼ� | H2���� | N2���� | NH3���� |
����(kJ��mol-1) | 436 | 945 | 391 |
��1�������ϱ��е������жϹ�ҵ�ϳɰ��ķ�Ӧ��__(��������������������)��Ӧ��
��2����298Kʱ��ȡ1molN2��3molH2����һ�ܱ������У��ڴ��������½��з�Ӧ������������2molNH3ʱ�ų������յ�����ΪQ����QΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ֱ���Ϊ�����������ֽ�ʵ�أ����ܷ�ӦΪ��Zn��2MnO2��H2O=ZnO��2MnOOH������˵����ȷ���ǣ� ��

A.�õ����Zn������
B.Zn�缫�Ϸ�����ԭ��Ӧ
C.�õ�ع���ʱ������Zn����������MnO2
D.��6.5gZn��ȫ�ܽ�ʱ��������·�ĵ��Ӹ���ԼΪ1.204��l023
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�������о�������ͼ��ʾ�Ķ�����̼��ѭ����ϵ�Խ������Ӿ������ЧӦ�����⣬��ϵͼ���ܷ�ӳ�Ļ�ѧ�۵��ѧ˼���У� ��
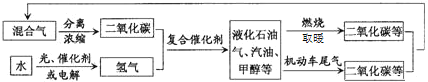
�ٶ�����̼Ҳ��һ����Ҫ����Դ��
�ڹ��ܻ���ܿ���ת��Ϊ��ѧ�ܣ�
��ȼ��ʱ��ѧ�ܿ���ת��Ϊ���ܣ�
��������л�������ת����
�ݻ�ѧ�仯��Ԫ���������غ��
A.�٢ڢ�B.�٢ܢ�C.�٢ڢܢ�D.�٢ڢۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ĺ��������Ϊ��ɫ��״���壬�����ڱ�ͪ���ȷºͱ��У��ڼ״����Ҵ������ѡ�ʯ�����п��ܽ⣬��ˮ�м������ܣ��۵�Ϊ156��157�������ȶ��Բ�������Ǹ�Ч�Ŀ�űҩ����֪�����ѷе�Ϊ35��������������ȡ�����صķ���֮һ������ȡԭ��Ϊ�����ģ���Ҫ�����ѽ�ȡ�������ͽ�ȡ�������ѽ�ȡ������Ҫ����Ϊ��

��ش��������⣺
��1����������и��������Ŀ����__________��
��2����������Ҫ�IJ���������Ҫ�У��ձ�����������__________����������������__________����������������__________��
��3��ͨ����ȼ�յķ����ⶨ�л���ķ���ʽ������ȼ�����ڽ��л�����Ʒ�봿���ڵ�¯�����³��ȼ�գ����ݲ�Ʒ������ȷ���л������ɡ���ͼ��ʾ������ȼ�շ�ȷ�������ط���ʽ��װ�á�
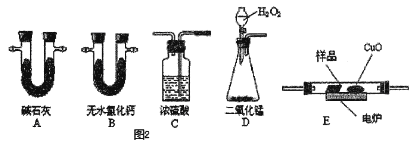
�������������IJ�����Ϣ��װ�õ�����˳��Ӧ��__________��ÿ��װ������һ������
����ʵ��װ�ÿ��ܻ��������ɲⶨ������ƫ�ͣ��Ľ�������__________��
����������Ʒ������Ϊ28.2 g���ú����Ľ����װ�������������Ƶ�A������66 g��B������19.8 g������������������ʽ��__________��
��Ҫȷ�����л���ķ���ʽ��������֪����������__________��
��4��ijѧ���������ص����ʽ���̽�����������ؼ��뺬��NaOH����̪��ˮ��Һ�У������ص��ܽ�����С�����Ȳ����裬�����ص��ܽ�����������Һ��ɫ��dz���������ػ�ѧ�������Ƶ�������__________������ĸ������
A���Ҵ� B������ C�������� D����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڱ���ϩ(![]() )������������
)������������
�����е�ԭ�Ӳ����ܹ��� �ڿ�����ˮ �ۿ����ڱ��� ����ʹ����KMnO4��Һ��ɫ
�ݿɷ����Ӿ۷�Ӧ ��1mol����ϩ��H2��Ӧ�������4molH2��������ȫ��ȷ��һ���ǣ� ��
A. �٢ڢܢ�B. �ۢܢݢ�C. �٢ۢݢ�D. �ڢۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Y��ZΪ������Ԫ�أ����������ڱ��е����λ����ͼ��ʾ����������Ԫ�ص�ԭ������������֮��Ϊ24��������˵������ȷ����
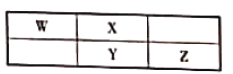
A.����������Ӧˮ��������ԣ�Z>Y
B.W����ͼ��⻯��������Z2��Ӧ�������W2�⣬����һ���Σ���ˮ��Һ������
C.��Ԫ�����ڱ��У�114��(��Ǧ)Ԫ����WԪ�ز�λ��ͬһ����
D.Y��Z���γ�YZ2��Y2Z2�ȷ��ӣ�ǰ�߳���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1,3-�����ϩ�����ǹ�ҵ�ϳ��õĽ��������������Ʊ������ܳ����Ӿۺ����ṹ��ͼ��ʾ�������й�1,3-�����ϩ������˵��������ǣ� ��
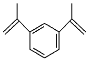
A.��һ�ȴ�����6��
B.��Һ���Ϻ�������ۿɷ���ȡ����Ӧ
C.����������̼ԭ�ӿ��ܴ���ͬһƽ��
D.�ܷ����Ӿ۷�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��KClO3��6HCl(Ũ)=KCl��3Cl2����3H2O����ͼ��ʾ���������Լ��ֱ�����������е���Ӧλ�ã�ʵ��ʱ��Ũ�������KClO3�����ϣ����ñ�����Ǻá��±�����ʵ������ó��Ľ�����ȫ��ȷ����(����)
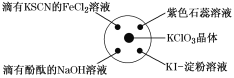
ѡ�� | ʵ������ | ���� |
A | ����KSCN��FeCl2��Һ��� | Cl2���л�ԭ�� |
B | ���з�̪��NaOH��Һ��ɫ | Cl2�������� |
C | ��ɫʯ����Һ�ȱ�����ɫ | Cl2����Ư���� |
D | KI������Һ�����ɫ | Cl2���������� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com