
【题目】1,3-二异丙烯基苯是工业上常用的交联剂,可用于制备高性能超分子聚合物,其结构如图所示。下列有关1,3-二异丙烯基苯的说法错误的是( )
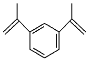
A.其一氯代物有6种
B.与液溴混合后加入铁粉可发生取代反应
C.分子中所有碳原子可能处于同一平面
D.能发生加聚反应
【答案】A
【解析】
分析1,3-二异丙烯基苯的结构可知,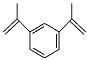 为对称结构,其分子中有5种等效氢:
为对称结构,其分子中有5种等效氢: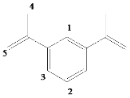 。根据等效氢的种数判断一氯取代物的同分异构体数目。根据与双键和苯环直接相连的原子共平面判断分子中原子共面情况。
。根据等效氢的种数判断一氯取代物的同分异构体数目。根据与双键和苯环直接相连的原子共平面判断分子中原子共面情况。
A.由分析可知,1,3-二异丙烯基苯分子中含有5种等效氢,则其一氯代物有5种,A项错误;
B.1,3-二异丙烯基苯分子中含有苯环,可与液溴在溴化铁的催化作用下发生取代反应,B项正确;
C.1,3-二异丙烯基苯中任一双键两侧的碳原子是处于同一平面的,当苯环与两双键处于同一平面时,分子中所有碳原子就处于同一平面,C项正确;
D.1,3-二异丙烯基苯分子中含有碳碳双键,可以发生加聚反应,D项正确;
答案选A。


科目:高中化学 来源: 题型:
【题目】四氯化钛(TiCl4)是制取航空材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3,不溶于水)制备TiCl4等产品的一种工艺流程示意如图:
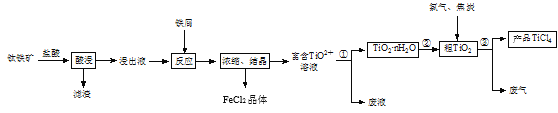
回答下列问题:
(1)“酸浸”时需要将钛铁矿粉碎,其目的是____。
(2)浸出液呈强酸性,含有TiO2+、Fe2+及少量Fe3+、Al3+等离子,则生成TiO2+的离子方程式是__。
(3)“反应”时需加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是____。
(4)通过控制条件,可以使过程①中生成的TiO2·nH2O形成一种液态分散系,用一束光照射该分散系能够产生丁达尔效应,则分散质颗粒直径的范围是____。
(5)过程①制得的固体TiO2·nH2O需用过量酸清洗以除去其中的Fe(OH)3杂质,检验Fe(OH)3杂质除净的实验方法是____。
(6)过程③生成的废气中含有CO,则TiO2和焦炭、氯气在高温下发生反应的化学方程式是___。
(7)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是____(只要求写出一项)。
(8)依据表中信息,可采用___方法精制含少量SiCl4杂质的TiCl4。
TiCl4 | SiCl4 | |
熔点/℃ | -25.0 | -68.8 |
沸点/℃ | 136.4 | 57.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)重整制取H2,具有无毒、无刺激性等优点。回答下列问题:
(1) CH3OCH3和O2发生反应Ⅰ: CH3OCH3(g)+![]() O2 (g) =2CO(g)+3H2(g) △H
O2 (g) =2CO(g)+3H2(g) △H
己知:CH3OCH3(g) =CO(g)+H2(g)+CH4(g) △H= a kJ/mol
CH4(g) +![]() O2 (g) = CO(g)+2H2O(g) △H= b kJ/mol
O2 (g) = CO(g)+2H2O(g) △H= b kJ/mol
H2(g)+![]() O2 (g) = H2O(g) △H= c kJ/mol
O2 (g) = H2O(g) △H= c kJ/mol
①则反应Ⅰ的△H=_________________ (用含a、b、c的代数式表示)。
②保持温度和压强不变,分别按不同进料比通入CH3OCH3和O2,发生反应Ⅰ。测得平衡时H2的体积百分含量与进料气中![]() 的关系如图(a)所示。当
的关系如图(a)所示。当![]() >0.6时,H2的体积百分含量快速降低,其最主要原因是_____
>0.6时,H2的体积百分含量快速降低,其最主要原因是_____![]() 填标号
填标号![]() 。
。
a 过量的O2起稀释作用
b 过量的O2与H2发生副反应生成H2O
c ![]() >0.6时平衡向逆反应方向移动
>0.6时平衡向逆反应方向移动
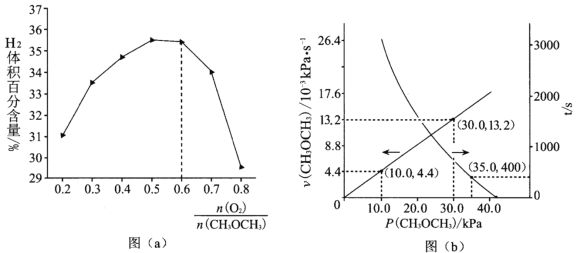
(2)T℃时,在刚性反应器中通入CH3OCH3,发生反应Ⅱ:CH3OCH3(g) =CO(g)+H2(g)+CH4(g) △H>0,测得容器内初始压强为41.6kPa,反应过程中反应速率v(CH3OCH3)、时间t与分压P(CH3OCH3)的关系如图(b)所示。
①t=400s时,CH3OCH3的分解率α=______(保留2位有效数字);
②反应速率满足v(CH3OCH3)=k Pn(CH3OCH3),n=_____,k=______s-1;400s时v(CH3OCH3)=___________kPa·s-1。
③一段时间后反应达到平衡,测得体系的总压强为121.6 kPa,则该反应的平衡常数Kp=_____kPa2。
④若提高该刚性反应器的温度,再次达到平衡后体系的压强P_____121.6 kPa(填“大于”、“等于”或“小于”),原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图曲线a和b是可溶性一元强碱与盐酸互滴的滴定曲线,下列说法正确的是
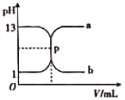
A.可溶性一元强碱、盐酸的物质的量浓度均为1mol·L-1
B.p点为滴定终点(两者恰好完全反应),溶液呈中性
C.酚酞不能用作该滴定的指示剂
D.曲线b是可溶性一元强碱滴定盐酸的滴定曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用图所示装置电解氯化铜溶液,实验中观察到碳(I)电极质量增加,碳(II)电极有气体放出。下列说法正确的是
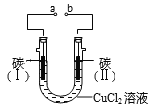
A. a为电源负极
B. 电极Ⅱ上发生还原反应
C. 电子流向:a→Ⅰ→Ⅱ→b
D. 该装置将电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室通常用无水乙醇和浓硫酸加热到170℃制取乙烯,反应方程式为:CH3CH2OH![]() CH2=CH2↑+H2O。若温度过高或加热时间过长,制得的乙烯往往混有CO2、SO2、H2O(g)。
CH2=CH2↑+H2O。若温度过高或加热时间过长,制得的乙烯往往混有CO2、SO2、H2O(g)。
(1)试用下图所示的装置设计一个实验,验证制得的气体中含有杂质气体:二氧化碳,二氧化硫和水蒸气,按气流的方向,各装置的连接顺序是 。

(2)实验时若观察到:①中A瓶中溶液褪色,B瓶中溶液颜色逐渐变浅,C瓶中溶液不褪色,则B瓶的作用是 ,C瓶的作用是 。
(3)若气体通过装置③中所盛溶液时,产生白色沉淀,它可以用来验证的气体是____。
(4)装置②中所加的试剂名称是____ _______。
(5)乙烯在一定条件下能制得聚乙烯,写出相应的化学反应方程式: 。
(6)某同学做此实验时发现装置④存在的不妥之处是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镍是电镀工业必不可少的化工原料。从不锈钢废渣(主要含Fe 42.35%、Cr 9.67%、Ni 5.1%、C 4.7%、Si 3.39%等)中制取硫酸镍晶体的工艺流程如下:

已知:①Cr3+与氨水反应时有少量Cr3+生成[Cr(NH3)6]3+,但加热时该络合物易分解。Ni2+与氨水反应生成[Ni(NH3)6]2+,该络合物加热时稳定,用硫酸酸化时生成相应的硫酸盐。
②Na2CrO4溶液中加酸调节pH为3.5时,CrO42﹣转化为Cr2O72﹣。
③相关物质在不同温度时溶解度如下表:
温度溶解度/g物质 | 20℃ | 30℃ | 40℃ | 60℃ | 80℃ | 90℃ |
Na2SO4 | 19.5 | 40.8 | 48.8 | 45.3 | 43.7 | 42.7 |
Na2Cr2O7 | 183 | 198 | 215 | 269 | 376 | 405 |
(1)“酸浸”后得到的溶液中主要含有FeSO4、NiSO4、Cr2(SO4)3,生成NiSO4的化学方程式为_____。“酸浸”时需控制温度为90℃左右,可以采用的加热方式是_____。
(2)“过滤”前,适当加热的目的是_____。
(3)对“过滤”所得的滤渣进行洗涤,检验滤渣已洗涤干净的方法是_____。
(4)“过滤”时产生的滤渣可用于制备Na2Cr2O7晶体。
①滤渣经干燥后与Na2CO3混合在空气中煅烧生成Na2CrO4和CO2,此反应的化学方程式为_____。
②请补充完整上述煅烧后混合物制备Na2Cr2O7晶体(橙红色)的实验方案:水浸,过滤,_____,得Na2Cr2O7晶体(必须使用的试剂有:硫酸,蒸馏水)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为某原电池装置:

(1)若A为铜,B为铁,电解质溶液为Fe2(SO4)3溶液,则铁片为______极(填“正”或“负”),A极电极反应式为_______,是_______(填“氧化反应”或“还原反应”)。
(2)若A为PbO2,B为Pb,电解质溶液为稀硫酸,放电时的方程式为:PbO2+Pb+2H2SO4=2PbSO4+2H2O,则B极的电极反应式为_________,H+向__________(填“正”或“负”)极移动。
(3)若A、B均为Pt电极,电解质溶液为稀硫酸,则向A极通入H2, B极通入O2,B极的反应为:O2+4e-+4H+=2H2O,则A极的电极反应式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl- 。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:
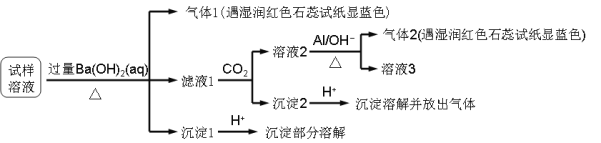
已知:3NO3-+ 8Al + 5OH- + 2H2O![]() 3NH3 + 8AlO2-
3NH3 + 8AlO2-
根据以上的实验操作与现象,该同学得出的结论不正确的是
试样中肯定存在NH4+、Mg2+、SO42-和NO3-
试样中一定不含Al3+
试样中可能存在Na+、Cl-
该雾霾中可能存在NaNO3 、NH4Cl和MgSO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com